摘要:(6′)甲.乙.丙三位同学各设计了一个实验.并都认为.如果观察到的现象和自己设计的方案一致.即可确证试液中含有SO42-. 甲的实验方案是:试样A白色沉淀沉淀不溶解, ⑴乙认为甲的实验不严谨.因为试样A中若含有 离子.也会有此现象. 乙的实验方案是:试样B白色沉淀沉淀不溶解, ⑵丙认为乙的实验不严谨.因为试样B中若含有 离子.也会有此现象. 丙的实验方案是:试样C现象Ⅰ现象Ⅱ, ⑶若丙方案合理.则回答:其中试剂I是 .现象I是 ,试剂II是 .现象II是 . (你若认为丙方案不合理.以上四空可以不填)
网址:http://m.1010jiajiao.com/timu3_id_160399[举报]
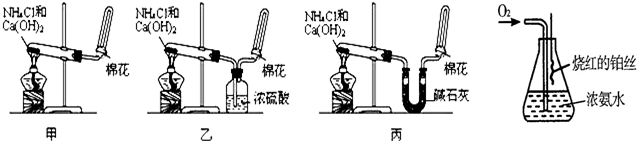
甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答问题:
(1)制取氨气的化学方程式为:
(2)三位同学都用向下排空气法收集氨气,其原因是
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为那位同学能够达到实验目的
(6)某课外活动小组查阅有关资料知,铂丝是氨氧化的催化剂.并设计进行了如图实验.实验过程中观察到:瓶口气体变为红棕色,瓶内出现白烟
写出此实验过程中化学反应方程式:

查看习题详情和答案>>
(1)制取氨气的化学方程式为:
2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O
;(2)三位同学都用向下排空气法收集氨气,其原因是
氨气的密度比空气小,氨气极易溶于水
氨气的密度比空气小,氨气极易溶于水
;(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是
乙
乙
填(“甲”、“乙”或“丙”);(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):
用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满
用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则氨气已满
.(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为那位同学能够达到实验目的
丙
丙
(填“甲”、“乙”或“丙”).他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为不能
不能
(填“能”或“不能”).(6)某课外活动小组查阅有关资料知,铂丝是氨氧化的催化剂.并设计进行了如图实验.实验过程中观察到:瓶口气体变为红棕色,瓶内出现白烟
写出此实验过程中化学反应方程式:
4NH3+5O2
4NO+6H2O
| ||
| 高温高压 |
4NH3+5O2
4NO+6H2O
;
| ||
| 高温高压 |
2NO+O2═2NO2
2NO+O2═2NO2
;3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
;NH3+HNO3═NH4NO3
NH3+HNO3═NH4NO3
.
甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答问题:
(1)制取氨气的化学方程式为:______;
(2)三位同学都用向下排空气法收集氨气,其原因是______;
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是______填(“甲”、“乙”或“丙”);
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):______.
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为那位同学能够达到实验目的______(填“甲”、“乙”或“丙”).他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为______(填“能”或“不能”).
(6)某课外活动小组查阅有关资料知,铂丝是氨氧化的催化剂.并设计进行了如图实验.实验过程中观察到:瓶口气体变为红棕色,瓶内出现白烟
写出此实验过程中化学反应方程式:______;______;______;______.
查看习题详情和答案>>
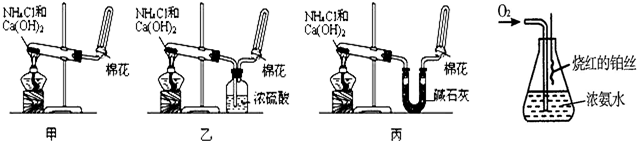
甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答问题:
(1)制取氨气的化学方程式为:______;
(2)三位同学都用向下排空气法收集氨气,其原因是______;
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是______填(“甲”、“乙”或“丙”);
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):______.
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为那位同学能够达到实验目的______(填“甲”、“乙”或“丙”).他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为______(填“能”或“不能”).
(6)某课外活动小组查阅有关资料知,铂丝是氨氧化的催化剂.并设计进行了如图实验.实验过程中观察到:瓶口气体变为红棕色,瓶内出现白烟
写出此实验过程中化学反应方程式:______;______;______;______.
查看习题详情和答案>>
(1)制取氨气的化学方程式为:______;
(2)三位同学都用向下排空气法收集氨气,其原因是______;
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是______填(“甲”、“乙”或“丙”);
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):______.
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为那位同学能够达到实验目的______(填“甲”、“乙”或“丙”).他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为______(填“能”或“不能”).
(6)某课外活动小组查阅有关资料知,铂丝是氨氧化的催化剂.并设计进行了如图实验.实验过程中观察到:瓶口气体变为红棕色,瓶内出现白烟
写出此实验过程中化学反应方程式:______;______;______;______.

甲、乙、丙三位同学分别用如下实验装置及化学药品(碱石灰为氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答问题:
(1)制取氨气的化学方程式为:______;
(2)三位同学都用向下排空气法收集氨气,其原因是______;
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是______填(“甲”、“乙”或“丙”);
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):______.
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为那位同学能够达到实验目的______(填“甲”、“乙”或“丙”).他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为______(填“能”或“不能”).
(6)某课外活动小组查阅有关资料知,铂丝是氨氧化的催化剂.并设计进行了如图实验.实验过程中观察到:瓶口气体变为红棕色,瓶内出现白烟
写出此实验过程中化学反应方程式:______高温高压4NO+6H2O 查看习题详情和答案>>
(1)制取氨气的化学方程式为:______;
(2)三位同学都用向下排空气法收集氨气,其原因是______;
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是______填(“甲”、“乙”或“丙”);
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):______.
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为那位同学能够达到实验目的______(填“甲”、“乙”或“丙”).他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为______(填“能”或“不能”).
(6)某课外活动小组查阅有关资料知,铂丝是氨氧化的催化剂.并设计进行了如图实验.实验过程中观察到:瓶口气体变为红棕色,瓶内出现白烟
写出此实验过程中化学反应方程式:______高温高压4NO+6H2O 查看习题详情和答案>>
某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案。(忽略锌镀层的氧化)甲同学的方案:先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度。
(1)甲同学的方案是否可行,说出理由: 。
乙同学的方案:通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:

(2)配制5%的盐酸1 L (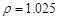 g/cm3
),需取用36.5% (
g/cm3
),需取用36.5% (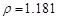 g/cm3
)的盐酸
mL
g/cm3
)的盐酸
mL
(保留一位小数)。
(3)若使用的镀锌铁皮的质量为28.357g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.00cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为 cm。丙同学的方案:通过如图所示装置,测量镀锌铁皮与稀H2SO4反应产生气体的质量来计算锌层的厚度。己称得镀锌铁皮质量为18.200g。

(4)实验所用称量仪器为 。
(5)若改用浓盐酸,则测出锌的厚度会 (填“偏大”、“偏小”、或“无影响”)。
(6)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢? 理由是: 。
查看习题详情和答案>>