网址:http://m.1010jiajiao.com/timu3_id_160283[举报]
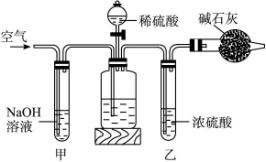
A.在干燥管内填满碱石灰,质量为m g。
B.取n g样品装入广口瓶中。
C.检验装置的气密性。
D.缓缓鼓入空气数分钟,再称干燥管质量为w g。
E.关闭止水夹。
F.打开止水夹。
G.缓缓加入稀硫酸至不再产生气体为止。
H.缓缓鼓入空气数分钟。
(1)正确的操作顺序是(填写符号):
C→________E→________→________→________→G→E→D
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是__________;装置甲的作用是__________;装置乙的作用是______________________________。
(3)计算溶液中Na2CO3质量分数的计算式为______________________________。
(4)若去掉装置甲,测定结果会;若去掉装置乙,测定结果会__________。(填“偏大”“偏小”或“无影响”)
查看习题详情和答案>>A.在干燥管内填满碱石灰,质量为mg
B.取ng样品装入广口瓶中
C.检验装置的气密性
D.缓缓鼓入空气数分钟,再称干燥管质量为wg
E.关闭止水夹
F.打开止水夹
G.缓缓加入稀硫酸至不再产生气体为止
H.缓缓鼓入空气数分钟
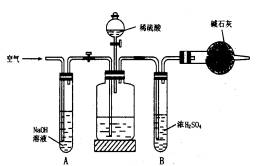
(1)正确的操作顺序是(填写符号):
C→________→F→________→E→________→G→________→D。
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是________;装置A的作用________;装置B的作用________。
(3)Na2CO3质量分数的计算式为________。
(4)若去掉装置A,测定结果________;若去掉装置B,测定结果________(填“偏大”“偏小”或“无影响”)。
查看习题详情和答案>>
工业生产的纯碱中常含有少量的NaCl等杂质,下图是测定产品中Na2CO3质量分数的实验装置,操作步骤有:
A.在干燥管内填满碱石灰,质量为mg
B.取ng样品装入广口瓶中
C.检验装置的气密性
D.缓缓鼓入空气数分钟,再称干燥管质量为wg
E.关闭止水夹
F.打开止水夹
G.缓缓加入稀硫酸至不再产生气体为止
H.缓缓鼓入空气数分钟
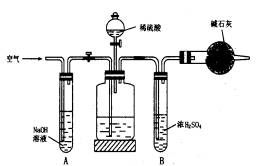
(1)正确的操作顺序是(填写符号):
C→________→F→________→E→________→G→________→D。
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是________;装置A的作用________;装置B的作用________。
(3)Na2CO3质量分数的计算式为________。
(4)若去掉装置A,测定结果________;若去掉装置B,测定结果________(填“偏大”“偏小”或“无影响”)。
查看习题详情和答案>>

实验步骤:
①检验装置的气密性;
②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m
③准确称量一定量的纯碱的质量(设为m
④从分液漏斗中缓缓滴入稀H2SO4,至不再产生气体为止;
⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为m
根据以上实验,回答下列问题:
(1)鼓入空气的目的是____________________________________________________。
(2)装置A中液体应用____________,其作用是______________________,如撤去装置A,直接向装置B中缓缓鼓入空气,测定结果将_____________(填“偏大”“偏小”或“不变”)。
(3)装置C的作用是__________________________________________________,如果撤去C,则会导致实验结果______________(填“偏大”“偏小”或“不变”)
(4)干燥管Ⅱ的作用是___________________________________________________。
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是______________,如果这两步操作太快,则会导致实验测定结果______________(填“偏大”“偏小”或“不变”)。
(6)根据实验,纯碱中Na2CO3的质量分数的计算式为______________________________。
查看习题详情和答案>>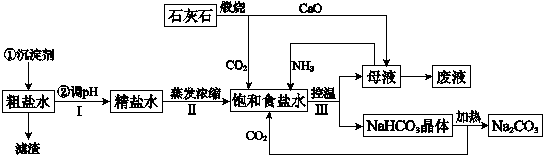
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分除过量的沉淀剂外还有_____________。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的化学方程式是_________________。
(3)向饱和食盐水中首先通入的气体是______,过程Ⅲ中生成NaHCO3晶体的反应的化学方程式是__________________。
(4)碳酸钠晶体失水的能量变化示意图如下:
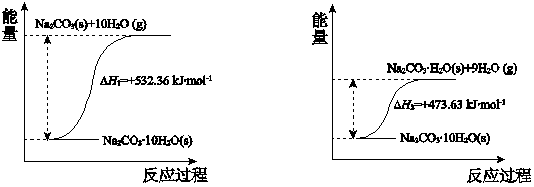
(5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。则该产品中Na2CO3的质量分数是__________。
(6)熔融Na2CO3可作甲烷--空气燃料电池的电解质,该电池负极的反应式是________________________。