题目内容
工业生产的纯碱中常含有少量的NaCl等杂质。如下图是测定产品中Na2CO3质量分数的实验装置。实验操作步骤有: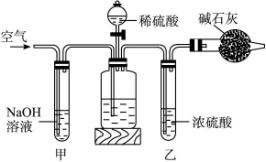
A.在干燥管内填满碱石灰,质量为m g。
B.取n g样品装入广口瓶中。
C.检验装置的气密性。
D.缓缓鼓入空气数分钟,再称干燥管质量为w g。
E.关闭止水夹。
F.打开止水夹。
G.缓缓加入稀硫酸至不再产生气体为止。
H.缓缓鼓入空气数分钟。
(1)正确的操作顺序是(填写符号):
C→________E→________→________→________→G→E→D
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是__________;装置甲的作用是__________;装置乙的作用是______________________________。
(3)计算溶液中Na2CO3质量分数的计算式为______________________________。
(4)若去掉装置甲,测定结果会;若去掉装置乙,测定结果会__________。(填“偏大”“偏小”或“无影响”)
(1)B H A F
(2)使广口瓶中产生的CO2气体全部排出 吸收空气中的CO2 吸收CO2中的水蒸气
(3)![]() ×100%
×100%
(4)偏大 偏大

| A、室温下在浓硝酸、浓盐酸和浓硫酸中分别投入光亮的铁钉,在盐酸中溶解最快 | B、在氯碱工业中,产物烧碱在阴极区得到,两极气态产物可用于合成盐酸 | C、纯碱可用于生产普通玻璃;硝酸可用于制化肥和炸药等 | D、工业盐酸和工业硝酸都常呈黄色,因所含杂质完全相同 |
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。


