摘要:Pb+PbO2+4H++2SO ==2PbSO4↓+2H2O 2e- Pb
网址:http://m.1010jiajiao.com/timu3_id_160075[举报]
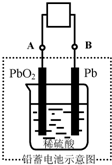
 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味.请回答以下问题:
(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则
A极为
负
负
极,发生氧化
氧化
反应,电极反应为Pb+SO42--2e-=PbSO4
Pb+SO42--2e-=PbSO4
B极为
正
正
极,发生还原
还原
反应,电极反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O
PbO2+4H++SO42-+2e-=PbSO4+2H2O
(2)请写出电解饱和食盐水的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
C极为
阴
阴
极,发生还原
还原
反应,电极反应为2H2O+2e-=H2 +2OH-↑
2H2O+2e-=H2 +2OH-↑
D极为
阳
阳
极,发生氧化
氧化
反应,电极反应为2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.150g/cm3)时,若电路上有0.2mol电子的电量通过,则
①铅蓄电池消耗H2SO4
2
2
mol.②电解池中收集到
2.24
2.24
L(标准状况下)氯气(假设氯气全部排出).③所得NaOH溶液中的物质的量浓度=
0.2mol/L
0.2mol/L
.剩余NaCl的密度为1.138g/cm3
1.138g/cm3
(假设体积不变).(4)氯碱工业生产中的电解饱和食盐水池中所用的高分子隔膜叫做
阳离子
阳离子
膜,所起的主要作用有①
让阳离子钠离子穿过达到,阻止氯离子和氢氧根离子穿过
让阳离子钠离子穿过达到,阻止氯离子和氢氧根离子穿过
②
防止氯气和氢气接触而发生反应
防止氯气和氢气接触而发生反应
③
防止氯气和氢氧化钠接触发生反应
防止氯气和氢氧化钠接触发生反应
. 铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸.电池总反应式为:Pb+PbO2+4H++2SO42-
铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸.电池总反应式为:Pb+PbO2+4H++2SO42- | 放电 | 充电 |
(1)放电时:负极的电极反应式是
Pb-2e-+SO42-═PbSO4
Pb-2e-+SO42-═PbSO4
;电解液中H2SO4的浓度将变小
小
;当外电路通过2mol电子时,理论上负极板的质量增加96
96
g.(2)在完全放电耗尽PbO2和Pb时,若按如图连接,电解一段时间后,则在A电极上生成
Pb
Pb
、在B电极上生成PbO2
PbO2
.(2012?泰州二模)某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:
Pb+PbO2+4H+
2Pb2++2H2O.
(1)放电时,正极的电极反应式为
(2)工业用PbO2来制备KClO4的工业流程如下:
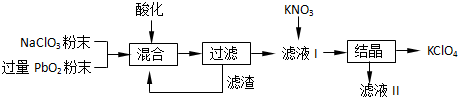
①写出NaClO3与PbO2反应的离子方程式:
②工业上可以利用滤液Ⅰ与KNO3发生反应制备KClO4的原因是
(3)PbO2会随温度升高逐步分解,称取23.9gPbO2,其受热分解过程中各物质的质量随温度的变化如图所示.
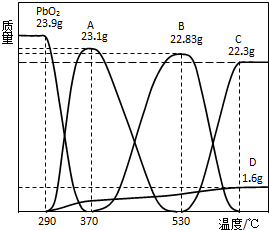
若在某温度下测得剩余固体的质量为22.94g,则该温度下PbO2分解所得固体产物的组成为
查看习题详情和答案>>
Pb+PbO2+4H+
| ||
| 充电 |
(1)放电时,正极的电极反应式为
4H++PbO2+2e-=Pb2++2H2O
4H++PbO2+2e-=Pb2++2H2O
;充电时,Pb电极应该连接在外接电源的负极
负极
(填“正极”或“负极”).(2)工业用PbO2来制备KClO4的工业流程如下:

①写出NaClO3与PbO2反应的离子方程式:
PbO2+ClO3-+2H+=Pb2++ClO4-+H2O
PbO2+ClO3-+2H+=Pb2++ClO4-+H2O
.②工业上可以利用滤液Ⅰ与KNO3发生反应制备KClO4的原因是
KClO4的溶解度较小
KClO4的溶解度较小
.(3)PbO2会随温度升高逐步分解,称取23.9gPbO2,其受热分解过程中各物质的质量随温度的变化如图所示.

若在某温度下测得剩余固体的质量为22.94g,则该温度下PbO2分解所得固体产物的组成为
Pb2O3和Pb3O4
Pb2O3和Pb3O4
(写化学式),其物质的量之比为1:1
1:1
. 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为: 铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为:
铅蓄电池是典型的可充型电池,它的正负极极板是惰性材料,电池总反应式为: