题目内容
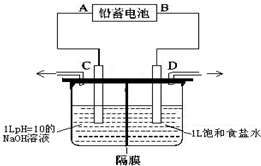
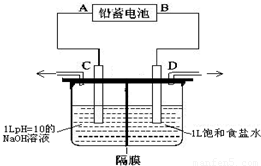
 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味.请回答以下问题:
(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则
A极为
负
负
极,发生氧化
氧化
反应,电极反应为Pb+SO42--2e-=PbSO4
Pb+SO42--2e-=PbSO4
B极为
正
正
极,发生还原
还原
反应,电极反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O
PbO2+4H++SO42-+2e-=PbSO4+2H2O
(2)请写出电解饱和食盐水的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
C极为
阴
阴
极,发生还原
还原
反应,电极反应为2H2O+2e-=H2 +2OH-↑
2H2O+2e-=H2 +2OH-↑
D极为
阳
阳
极,发生氧化
氧化
反应,电极反应为2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.150g/cm3)时,若电路上有0.2mol电子的电量通过,则
①铅蓄电池消耗H2SO4
2
2
mol.②电解池中收集到
2.24
2.24
L(标准状况下)氯气(假设氯气全部排出).③所得NaOH溶液中的物质的量浓度=
0.2mol/L
0.2mol/L
.剩余NaCl的密度为1.138g/cm3
1.138g/cm3
(假设体积不变).(4)氯碱工业生产中的电解饱和食盐水池中所用的高分子隔膜叫做
阳离子
阳离子
膜,所起的主要作用有①
让阳离子钠离子穿过达到,阻止氯离子和氢氧根离子穿过
让阳离子钠离子穿过达到,阻止氯离子和氢氧根离子穿过
②
防止氯气和氢气接触而发生反应
防止氯气和氢气接触而发生反应
③
防止氯气和氢氧化钠接触发生反应
防止氯气和氢氧化钠接触发生反应
.分析:电解一段时间后,若在电解池中C极一侧出来的气体无色无味氢气,则C极是阴极,D极一侧出来的气体呈黄绿色有刺激性气味氯气,D极是阳极,所以原电池中A极是负极,B极是正极;
(1)铅蓄电池中,负极是铅,负极上铅失电子发生氧化反应,正极上二氧化铅得电子发生还原反应;
(2)电解饱和食盐水时,阴极上得电子生成氢气,阳极上失电子生成氯气,写出电极反应式;
(3)根据各物质和转移电子之间的关系式进行分析解答;
(4)离子交换膜只能部分离子通过,从而阻止物质之间接触而反应.
(1)铅蓄电池中,负极是铅,负极上铅失电子发生氧化反应,正极上二氧化铅得电子发生还原反应;
(2)电解饱和食盐水时,阴极上得电子生成氢气,阳极上失电子生成氯气,写出电极反应式;
(3)根据各物质和转移电子之间的关系式进行分析解答;
(4)离子交换膜只能部分离子通过,从而阻止物质之间接触而反应.
解答:解:电解一段时间后,若在电解池中C极一侧出来的气体无色无味氢气,则C极是阴极,D极一侧出来的气体呈黄绿色有刺激性气味氯气,D极是阳极,所以原电池中A极是负极,B极是正极;
(1)A是负极,负极上铅失电子和硫酸根离子反应生成硫酸铅,该反应属于氧化反应,电极反应式为:Pb+SO42--2e-=PbSO4,
B是正极,正极上二氧化铅得电子和硫酸反应生成硫酸铅、水,该反应属于还原反应,电极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,
故答案为:负,氧化,Pb+SO42--2e-=PbSO4;正,还原,PbO2+4H++SO42-+2e-=PbSO4+2H2O;
(2)电解氯化钠溶液时,C是阴极,阴极上得电子发生还原反应,电极反应式为:2H2O+2e-=H2 +2OH-↑,D是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,同时生成氢氧化钠,所以其电池反应式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,阴极,还原,2H2O+2e-=H2 +2OH-↑,阳极,氧化,2Cl--2e-=Cl2↑;
(3)Pb+PbO2+2H2SO4=2PbSO4+2H2O转移电子
2mol 2mol
根据硫酸和转移电子的关系知,当转移2mol电子时,消耗硫酸的物质的量是2mol,则转移0.2mol电子时消耗硫酸的物质的量是0.2mol;
2NaCl+2H2O
2NaOH+H2↑+Cl2↑转移电子
22.4L 2mol
根据氯气和转移电子的关系式知,当生成22.4L氯气时转移电子的物质的量是2mol,当转移0.2mol电子时生成2.24L氯气;
2NaCl+2H2O
2NaOH+H2↑+Cl2↑转移电子
2mol 2mol
根据氢氧化钠和转移电子的关系式知,生成2mol氢氧化钠时转移电子的物质的量是2mol,当转移0.2mol电子时生成0.2mol氢氧化钠,C(NaOH)=
=0.2mol/L;
2NaCl+2H2O
2NaOH+H2↑+Cl2↑转移电子
117g 2mol
根据氯化钠和转移电子的关系式知,当转移2mol电子消耗117g氯化钠,则转移0.2mol电子时消耗11.7g氯化钠,溶液中含有氯化钠的质量=1.150g/cm3×1000cm3-11.7g=1138.3g,ρ=
=1.138g/cm3,
故答案为:0.2,2.24,0.2mol/L,1.138g/cm3;
(4)氯碱工业生产中的电解饱和食盐水池中所用的高分子隔膜叫做阳离子膜,其作用有:让阳离子钠离子穿过达到,阻止氯离子和氢氧根离子穿过,防止氯气和氢气接触而发生反应,防止氯气和氢氧化钠接触发生反应,
故答案为:阳离子,让阳离子钠离子穿过达到,阻止氯离子和氢氧根离子穿过,防止氯气和氢气接触而发生反应,防止氯气和氢氧化钠接触发生反应.
(1)A是负极,负极上铅失电子和硫酸根离子反应生成硫酸铅,该反应属于氧化反应,电极反应式为:Pb+SO42--2e-=PbSO4,
B是正极,正极上二氧化铅得电子和硫酸反应生成硫酸铅、水,该反应属于还原反应,电极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O,
故答案为:负,氧化,Pb+SO42--2e-=PbSO4;正,还原,PbO2+4H++SO42-+2e-=PbSO4+2H2O;
(2)电解氯化钠溶液时,C是阴极,阴极上得电子发生还原反应,电极反应式为:2H2O+2e-=H2 +2OH-↑,D是阳极,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,同时生成氢氧化钠,所以其电池反应式为:2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
(3)Pb+PbO2+2H2SO4=2PbSO4+2H2O转移电子
2mol 2mol
根据硫酸和转移电子的关系知,当转移2mol电子时,消耗硫酸的物质的量是2mol,则转移0.2mol电子时消耗硫酸的物质的量是0.2mol;
2NaCl+2H2O
| ||
22.4L 2mol
根据氯气和转移电子的关系式知,当生成22.4L氯气时转移电子的物质的量是2mol,当转移0.2mol电子时生成2.24L氯气;
2NaCl+2H2O
| ||
2mol 2mol
根据氢氧化钠和转移电子的关系式知,生成2mol氢氧化钠时转移电子的物质的量是2mol,当转移0.2mol电子时生成0.2mol氢氧化钠,C(NaOH)=
| 0.2mol |
| 1L |
2NaCl+2H2O
| ||
117g 2mol
根据氯化钠和转移电子的关系式知,当转移2mol电子消耗117g氯化钠,则转移0.2mol电子时消耗11.7g氯化钠,溶液中含有氯化钠的质量=1.150g/cm3×1000cm3-11.7g=1138.3g,ρ=
| 1138.3g |
| 1000cm3 |
故答案为:0.2,2.24,0.2mol/L,1.138g/cm3;
(4)氯碱工业生产中的电解饱和食盐水池中所用的高分子隔膜叫做阳离子膜,其作用有:让阳离子钠离子穿过达到,阻止氯离子和氢氧根离子穿过,防止氯气和氢气接触而发生反应,防止氯气和氢氧化钠接触发生反应,
故答案为:阳离子,让阳离子钠离子穿过达到,阻止氯离子和氢氧根离子穿过,防止氯气和氢气接触而发生反应,防止氯气和氢氧化钠接触发生反应.
点评:本题考查了原电池和电解池原理,根据电解池电极上发生的反应来确定电解池阴阳极和原电池正负极,再根据物质和转移电子之间的关系式进行计算,电极反应式的书写是高考热点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
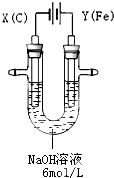 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.