摘要:将1.792LSO2缓慢通入1L.0.1mol/L的NaOH溶液中.求所得溶液中溶质成分及物质的量.
网址:http://m.1010jiajiao.com/timu3_id_159060[举报]
[化学--选修化学与技术]
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料.其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中.
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中.
3种钙盐的溶解度随溶液pH的变化如图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3?H2O=Ca5(PO4)3OH↓+
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
(4)图中所示3种钙盐在人体中最稳定的存在形式是
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.结合化学平衡移动原理,分析其原因

查看习题详情和答案>>
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料.其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中.
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中.
3种钙盐的溶解度随溶液pH的变化如图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3?H2O=Ca5(PO4)3OH↓+
10NH4NO3
10NH4NO3
+3H2O
3H2O
②5Ca(OH)2+3H3PO4=
Ca5(PO4)3OH↓+9H2O
Ca5(PO4)3OH↓+9H2O
(2)与方法A相比,方法B的优点是
唯一副产物为水,工艺简单
唯一副产物为水,工艺简单
.(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
反应液局部酸性过大,会有CaHPO4产生
反应液局部酸性过大,会有CaHPO4产生
.(4)图中所示3种钙盐在人体中最稳定的存在形式是
Ca5(PO4)3OH
Ca5(PO4)3OH
(填化学式).(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.结合化学平衡移动原理,分析其原因
酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
. 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
(2008?镇江二模)世界环保组织2006年度报告指出,人类已成功地使大气中氟氯烃减少,但C、N、S氧化物的排放有增无减,水资源的紧缺和污染加剧.
(1)大气中氟氯烃的减少带来的积极效应是
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质.
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:
②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为:
(3)回收利用SO2既能减少大气污染,又能充分利用资源.已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用.某同学设计测定转化器的脱硫效率方案如下:
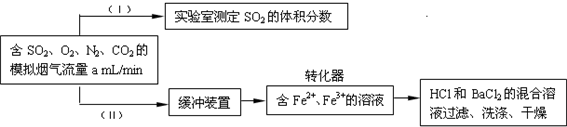
①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
查看习题详情和答案>>
(1)大气中氟氯烃的减少带来的积极效应是
减缓臭氧层空洞的增大
减缓臭氧层空洞的增大
.(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质.
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:

②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为:
2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.(3)回收利用SO2既能减少大气污染,又能充分利用资源.已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用.某同学设计测定转化器的脱硫效率方案如下:

①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
高锰酸钾溶液(或碘水和淀粉的混合液)
高锰酸钾溶液(或碘水和淀粉的混合液)
溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标况下)来计算SO2 的体积分数.②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
实验时间
实验时间
和BaSO4的质量
BaSO4的质量
.MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果.某兴趣小组通过实验研究MnO2性质.
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是 .
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄氯色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比实验:
①该小组从上述对比实验中,可以得出的结论是 .
②写出在酸性条件下MnO2氧化I-的离子方程式 .
(3)为了探究MnO2的催化效果,需要用30%的H2O2溶液(密度按1g/cm3)配制浓度为3%的H2O2溶液(密度按1g/cm3)100mL.配制过程中除了用到量筒、烧杯、100mL容量瓶外,还需用到的玻璃仪器名称是 ,需用量筒量取 mL30%的H2O2溶液.MnO2催化H2O2分解的化学方程式为 ,反应结束后将液体与MnO2分离的实验操作名称叫 .
(4)实验室用MnO2制取氯气的化学方程式为 .
(5)MnO2可用于制作干电池,电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为 .
查看习题详情和答案>>
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄氯色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比实验:
| 实验 | 外加试剂 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸 | 迅速变棕褐色 |
②写出在酸性条件下MnO2氧化I-的离子方程式
(3)为了探究MnO2的催化效果,需要用30%的H2O2溶液(密度按1g/cm3)配制浓度为3%的H2O2溶液(密度按1g/cm3)100mL.配制过程中除了用到量筒、烧杯、100mL容量瓶外,还需用到的玻璃仪器名称是
(4)实验室用MnO2制取氯气的化学方程式为
(5)MnO2可用于制作干电池,电池总反应为:Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果.某兴趣小组通过实验研究MnO2性质.
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比实验:
①该小组从上述对比实验中,可以得出的结论是
②写出在酸性条件下MnO2氧化I-的离子方程式
(3)为了探究MnO2的催化效果,需要用30%的H2O2溶液(密度按1g/cm3)配制浓度为3%的H2O2溶液(密度按1g/cm3)100mL.配制过程中除了用到量筒、烧杯、100mL容量瓶外,还需用到的玻璃仪器名称是
(4)实验室用MnO2制取氯气的化学方程式为
查看习题详情和答案>>
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是
A
A
.A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比实验:
| 实验 | 外加试剂 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸 | 迅速变棕褐色 |
酸性越强,MnO2氧化性越强
酸性越强,MnO2氧化性越强
.②写出在酸性条件下MnO2氧化I-的离子方程式
2I-+MnO2+4H+═I2+Mn2++2H2O
2I-+MnO2+4H+═I2+Mn2++2H2O
.(3)为了探究MnO2的催化效果,需要用30%的H2O2溶液(密度按1g/cm3)配制浓度为3%的H2O2溶液(密度按1g/cm3)100mL.配制过程中除了用到量筒、烧杯、100mL容量瓶外,还需用到的玻璃仪器名称是
玻璃棒、胶头滴管
玻璃棒、胶头滴管
,需用量筒量取10.0
10.0
mL30%的H2O2溶液.MnO2催化H2O2分解的化学方程式为2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,反应结束后将液体与MnO2分离的实验操作名称叫
| ||
过滤
过滤
.(4)实验室用MnO2制取氯气的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2 ↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2 ↑+2H2O
.
| ||
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体.硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是
(3)检验淀粉是否水解完全所用的试剂为
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020mol?L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为
查看习题详情和答案>>

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体.硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:
催化剂的作用
催化剂的作用
.(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是
温度过高,硝酸浓度过大,导致H2C2O4进一步被氧化
温度过高,硝酸浓度过大,导致H2C2O4进一步被氧化
.(3)检验淀粉是否水解完全所用的试剂为
碘水
碘水
.(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有
布氏漏斗、吸滤器
布氏漏斗、吸滤器
.(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020mol?L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为
无色突变为淡紫色且半分钟不褪色
无色突变为淡紫色且半分钟不褪色
.滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为84%
84%
.