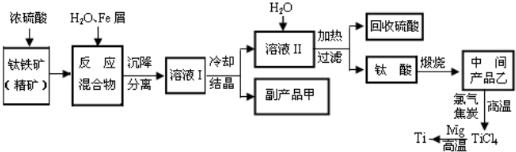
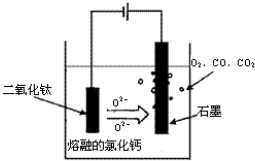
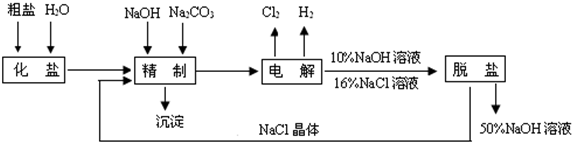
题目内容
[化学--选修化学与技术]
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料.其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中.
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中.
3种钙盐的溶解度随溶液pH的变化如图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3?H2O=Ca5(PO4)3OH↓+
②5Ca(OH)2+3H3PO4=
(2)与方法A相比,方法B的优点是
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
(4)图中所示3种钙盐在人体中最稳定的存在形式是
(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.结合化学平衡移动原理,分析其原因

羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料.其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中.
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中.
3种钙盐的溶解度随溶液pH的变化如图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3?H2O=Ca5(PO4)3OH↓+
10NH4NO3
10NH4NO3
+3H2O
3H2O
②5Ca(OH)2+3H3PO4=
Ca5(PO4)3OH↓+9H2O
Ca5(PO4)3OH↓+9H2O
(2)与方法A相比,方法B的优点是
唯一副产物为水,工艺简单
唯一副产物为水,工艺简单
.(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是
反应液局部酸性过大,会有CaHPO4产生
反应液局部酸性过大,会有CaHPO4产生
.(4)图中所示3种钙盐在人体中最稳定的存在形式是
Ca5(PO4)3OH
Ca5(PO4)3OH
(填化学式).(5)糖沾附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿.结合化学平衡移动原理,分析其原因
酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
. 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
分析:根据原子守恒可以配平反应方程式,方法A与方法B对比,主要是A产物有副产物NH4NO3,原子利用率不高.本题后二问要利用平衡思想解决,人体pH基本上在7.39~7.41,所以钙主要存在形式为Ca5(PO4)3OH,结合其电离平衡可以分析酸会促进其电离而溶解,造成龋齿.
解答:解:(1)①从质量守恒的角度思考,5molCa(NO3)2、3mol(NH4)2HPO4和4molNH3?H2O反应生成1molCa5(PO4)3OH、10molNH4NO3和3molH2O,反应的化学方程式为,5Ca(NO3)2+3(NH4)2HPO4+4NH3?H2O=Ca5(PO4)3OH↓+10NH4NO3+3H2O
故答案为:10NH4NO3;3H2O;
②从质量守恒的角度思考,5molCa(OH)2和3molH3PO4反应生成1molCa5(PO4)3OH和9molH2O,
反应的化学方程式为5Ca(OH)2+3H3PO4=Ca5(PO4)3OH↓+9H2O,
故答案为:Ca5(PO4)3OH↓+9H2O;
(2)与方法A相比,方法B的优点是副产品为水,没有其它副产品,工艺简单,
故答案为:唯一副产物为水,工艺简单;
(3)方法B中,如果H3PO4溶液滴加过快,会导致局部酸性过大,生成CaHPO4,制得的产物不纯,
故答案为:反应液局部酸性过大,会有CaHPO4产生;
(4)人体pH基本上在7.39~7.41,所以钙主要存在形式为Ca5(PO4)3OH,
故答案为:Ca5(PO4)3OH;
(5)反应平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq),酸性物质使沉淀溶解向右移动,导致Ca5(PO4)3OH溶解,造成龋齿,
5Ca2+(aq)+3PO43-(aq)+OH-(aq),酸性物质使沉淀溶解向右移动,导致Ca5(PO4)3OH溶解,造成龋齿,
故答案为:酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿.
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿.
故答案为:10NH4NO3;3H2O;
②从质量守恒的角度思考,5molCa(OH)2和3molH3PO4反应生成1molCa5(PO4)3OH和9molH2O,
反应的化学方程式为5Ca(OH)2+3H3PO4=Ca5(PO4)3OH↓+9H2O,
故答案为:Ca5(PO4)3OH↓+9H2O;
(2)与方法A相比,方法B的优点是副产品为水,没有其它副产品,工艺简单,
故答案为:唯一副产物为水,工艺简单;
(3)方法B中,如果H3PO4溶液滴加过快,会导致局部酸性过大,生成CaHPO4,制得的产物不纯,
故答案为:反应液局部酸性过大,会有CaHPO4产生;
(4)人体pH基本上在7.39~7.41,所以钙主要存在形式为Ca5(PO4)3OH,
故答案为:Ca5(PO4)3OH;
(5)反应平衡:Ca5(PO4)3OH(s)
 5Ca2+(aq)+3PO43-(aq)+OH-(aq),酸性物质使沉淀溶解向右移动,导致Ca5(PO4)3OH溶解,造成龋齿,
5Ca2+(aq)+3PO43-(aq)+OH-(aq),酸性物质使沉淀溶解向右移动,导致Ca5(PO4)3OH溶解,造成龋齿,故答案为:酸性物质使沉淀溶解平衡:Ca5(PO4)3OH(s)
 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿.
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿.点评:本题考查学生对难溶电解质的溶解平衡和酸碱反应的了解,考查学生书写化学反应方程形式的能力、读图解析和方案评价能力,以及化学平衡知识的综合应用能力.难度,中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目