摘要:解:设样品中CuCl2的质量为x,NaOH溶液中含NaOH质量为y NaCl的质量为5.85×20.0% = 1.17g CuCl2 + 2NaOH == Cu(OH)2↓ + 2NaCl 135 80 117 x y 1.17g (1) 135︰x == 117︰1.17 x=1.35g 样品中CuCl2的质量分数为: 80︰y == 117︰1.17g y = 0.80g NaOH溶液中水的质量为: 5.85g - 1.17g = 4.68g 所以NaOH溶液的质量为: 0.80g + 4.68g = 5.48g 解法(二)先算出氢氧化铜的质量0.98g NaOH溶液的质量为:5.85g + 0.98g - 1.35g = 5.48g 本题其它合理解法参照第小题2分原则给分. 本题在计算过程中未考虑有效数字应扣0.5分.
网址:http://m.1010jiajiao.com/timu3_id_1590[举报]
(2012?仪征市二模)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
[查阅资料]
①生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②生产原理反应(2):NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物.
③氯化铵分解的化学方程式是NH4Cl
NH3↑+HCl↑.
④部分生产流程如图所示:
[问题讨论]
(1)①溶液A中的溶质有NaCl和
③流程中NaOH溶液的作用是除去粗盐中的
④写出加入Na2CO3溶液所发生反应的化学方程式
(2)上述生产流程中可循环使用的是
A.CO2 B.NH3 C.HCl D.NaOH
[组成探究一](3)①晶体A受热分解的化学方程式为
②设计实验检验纯碱样品中是否混有晶体A,请完成下表:
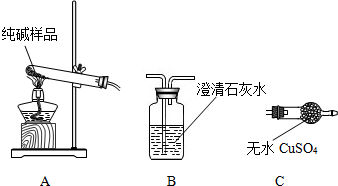
[组成探究二](4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为
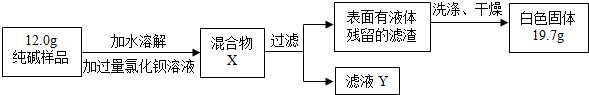
[组成探究三](5)同学们为了测定该纯碱样品的纯度,设计了如下实验:
①判断加入氯化钡溶液是否过量的合适方法是
A.静置混合物X,向上层清液中再滴少许氯化钡溶液 B.向滤液Y中滴加少许氯化钡溶液
②判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加
A.氯化钡溶液 B.稀硫酸 C.碳酸钠溶液 D.稀盐酸
③根据实验数据,计算样品中碳酸钠的质量分数为
[Mr(BaCl2)=208 Mr(Na2CO3)=106 Mr(BaCO3)=197Mr(NaCl)=58.5].
查看习题详情和答案>>
[查阅资料]
①生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②生产原理反应(2):NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物.
③氯化铵分解的化学方程式是NH4Cl
| ||
④部分生产流程如图所示:

[问题讨论]
(1)①溶液A中的溶质有NaCl和
NaOH(氢氧化钠)
NaOH(氢氧化钠)
、Na2CO3(碳酸钠)
Na2CO3(碳酸钠)
,②操作Ⅱ的名称为过滤
过滤
.③流程中NaOH溶液的作用是除去粗盐中的
MgCl2(氯化镁)
MgCl2(氯化镁)
.④写出加入Na2CO3溶液所发生反应的化学方程式
CaCl2+Na2CO3═CaCO3↓+2NaCl
CaCl2+Na2CO3═CaCO3↓+2NaCl
.(2)上述生产流程中可循环使用的是
ABC
ABC
(填序号).A.CO2 B.NH3 C.HCl D.NaOH
[组成探究一](3)①晶体A受热分解的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
.
| ||
②设计实验检验纯碱样品中是否混有晶体A,请完成下表:
| 选择的装置 | 实验现象 | 实验结论 |
AB”或“AC”或“ACB AB”或“AC”或“ACB |
“B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” “B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” |
样品不含晶体A |

[组成探究二](4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为
AgNO3+NaCl═AgCl↓+NaNO3
AgNO3+NaCl═AgCl↓+NaNO3
,由此确定纯碱样品含有杂质NaCl.
[组成探究三](5)同学们为了测定该纯碱样品的纯度,设计了如下实验:
①判断加入氯化钡溶液是否过量的合适方法是
A
A
,然后观察现象判断.A.静置混合物X,向上层清液中再滴少许氯化钡溶液 B.向滤液Y中滴加少许氯化钡溶液
②判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加
BC
BC
,然后观察现象判断.A.氯化钡溶液 B.稀硫酸 C.碳酸钠溶液 D.稀盐酸
③根据实验数据,计算样品中碳酸钠的质量分数为
解:设样品中碳酸钠的质量是X
BaCl2+Na2CO3═BaCO3↓+2NaCl
106 197
X 19.7g
=
X=10.6g
所以样品中碳酸钠的质量分数是:
×100%=88.3%
答:样品中碳酸钠的质量分数是88.3%
BaCl2+Na2CO3═BaCO3↓+2NaCl
106 197
X 19.7g
| 106 |
| X |
| 197 |
| 19.7g |
X=10.6g
所以样品中碳酸钠的质量分数是:
| 10.6g |
| 12.0g |
答:样品中碳酸钠的质量分数是88.3%
解:设样品中碳酸钠的质量是X
BaCl2+Na2CO3═BaCO3↓+2NaCl
106 197
X 19.7g
=
X=10.6g
所以样品中碳酸钠的质量分数是:
×100%=88.3%
答:样品中碳酸钠的质量分数是88.3%
(写出计算过程.4分)BaCl2+Na2CO3═BaCO3↓+2NaCl
106 197
X 19.7g
| 106 |
| X |
| 197 |
| 19.7g |
X=10.6g
所以样品中碳酸钠的质量分数是:
| 10.6g |
| 12.0g |
答:样品中碳酸钠的质量分数是88.3%
[Mr(BaCl2)=208 Mr(Na2CO3)=106 Mr(BaCO3)=197Mr(NaCl)=58.5].
氢氧化钠固体常因吸收空气中的二氧化碳而变质.某研究性学习小组为探究氢氧化钠固体样品中的碳酸钠的质量分数(仅考虑样品为NaOH和Na2CO3的混合物),设计了多种实验方案,请结合以下方案回答有关问题:
方案一:
称取一定量的氢氧化钠样品,加水溶解后,逐滴加入沉淀剂氢氧化钡溶液至不再产生沉淀为止.将沉淀过滤、洗涤、烘干、称量.
则:(1)沉淀洗涤的目的是 ,若不洗涤,则所测定的样品中碳酸钠的质量分数 (填“偏大”、“偏小”或“无影响”).证明沉淀已经洗涤干净的方法:向最后一次洗涤后的滤液中加入 试剂(填化学式),若无沉淀产生,说明洗涤干净.
方案二:
(2)利用下图装置测定氢氧化钠样品中 Na2CO3的质量分数,则必需的数据有:样品质量、反应前 锥形瓶及其中各物质的总质量、 .该方案有误差,请写出引起误差的一个原因: .
锥形瓶及其中各物质的总质量、 .该方案有误差,请写出引起误差的一个原因: .
方案三:
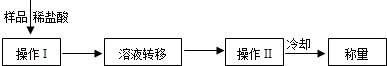
(3)操作Ⅰ中加入稀盐酸应过量的原因是 ,
操作Ⅱ中需要的仪器有铁架台(含铁圈)、玻璃棒、酒精灯和 ,若该方案中样品质量为9.3g,最终称量冷却后的晶体质量为11.7g.
为计算碳酸钠的质量分数,小刚同学通过列二元一次方程组的办法得到两个表达式:
解:设样品中NaOH的质量为x,Na2CO3的质量为y.
请判断这两个方程组中是否存在问题,若有错误,请将纠正后的方程写在横线上: .
经计算碳酸钠的质量分数为 .(写出计算过程)
查看习题详情和答案>>
方案一:
称取一定量的氢氧化钠样品,加水溶解后,逐滴加入沉淀剂氢氧化钡溶液至不再产生沉淀为止.将沉淀过滤、洗涤、烘干、称量.
则:(1)沉淀洗涤的目的是
方案二:
(2)利用下图装置测定氢氧化钠样品中 Na2CO3的质量分数,则必需的数据有:样品质量、反应前
 锥形瓶及其中各物质的总质量、
锥形瓶及其中各物质的总质量、方案三:

(3)操作Ⅰ中加入稀盐酸应过量的原因是
操作Ⅱ中需要的仪器有铁架台(含铁圈)、玻璃棒、酒精灯和
为计算碳酸钠的质量分数,小刚同学通过列二元一次方程组的办法得到两个表达式:
解:设样品中NaOH的质量为x,Na2CO3的质量为y.
|
请判断这两个方程组中是否存在问题,若有错误,请将纠正后的方程写在横线上:
经计算碳酸钠的质量分数为
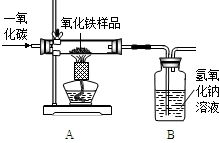 现有一种不纯的氧化铁粉末样品(杂质为铁粉),小刚和小强通过实验测定样品中氧化铁的质量分数.请你回答相关问题:
现有一种不纯的氧化铁粉末样品(杂质为铁粉),小刚和小强通过实验测定样品中氧化铁的质量分数.请你回答相关问题:(1)小刚称取10g样品,利用下图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)
| 编号 | 称量物 | 反应前 | 反应后 |
| 一 | 硬质玻璃管及所盛固体总质量 | 76.2g | 73.8g |
| 二 | B装置总质量 | 153.7g | 160.3g |
②请根据B装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程).
解:设样品中氧化铁的质量为x.
(2)为达到同样的实验目的,小强设计的方案为:将一定质量的样品于过量的稀盐酸反应,准确称量反应前、后固体和液体物质的总质量,据此可求出氧化铁的质量分数.
请你分别对小刚和小强设计的实验方案进行评价(各写出一条即可):
(3)如果小强还想计算出所用稀盐酸的溶质质量分数,请简要说明对其方案的改进方法及原因:
(2013?江宁区一模)对牙膏的探究要用到许多化学知识.
(1)用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,某实验小组同学设计了2种转化流程,如下图1所示.
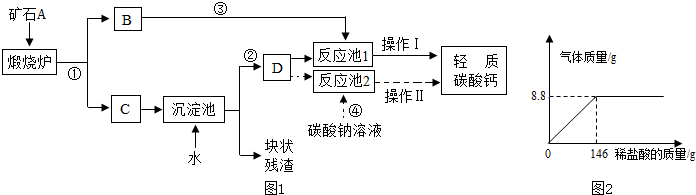 请回答下列问题:
请回答下列问题:
a.小王同学主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单.
请写出反应①和④的化学方程式:①
b.操作Ⅱ包括搅拌、
c.小李同学认为流程①、②、③和操作I比小王的主张更好,其理由是:
操作I包括搅拌和微热等工序.
(2)该实验小组为了测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图2所示.请完成下列计算内容:
①样品中碳酸钙的质量分数是多少?
②所用稀盐酸溶质的质量分数是多少?
(写出计算过程)
查看习题详情和答案>>
(1)用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,某实验小组同学设计了2种转化流程,如下图1所示.
 请回答下列问题:
请回答下列问题:a.小王同学主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单.
请写出反应①和④的化学方程式:①
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
;④
| ||
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
;b.操作Ⅱ包括搅拌、
过滤
过滤
、洗涤、干燥等工序.c.小李同学认为流程①、②、③和操作I比小王的主张更好,其理由是:
利用产生的二氧化碳比另加碳酸钠溶液更经济,生成成本更低,若产生的二氧化碳不回收直接排放,不利于“节能减排”
利用产生的二氧化碳比另加碳酸钠溶液更经济,生成成本更低,若产生的二氧化碳不回收直接排放,不利于“节能减排”
;操作I包括搅拌和微热等工序.
(2)该实验小组为了测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图2所示.请完成下列计算内容:
①样品中碳酸钙的质量分数是多少?
②所用稀盐酸溶质的质量分数是多少?
(写出计算过程)
解:设样品中CaCO3的质量为x,参加反应的稀盐酸中HCl的质量为y
CaCO3+2HCl=CaCl2+CO2↑+H2O
1007344
xy8.8g
根据
=
解得x=20 根据
=
解得y=14.6g
样品中CaCO3的质量分数为:
×100%=80%
稀盐酸的溶质质量分数为:
×100%=10%
CaCO3+2HCl=CaCl2+CO2↑+H2O
1007344
xy8.8g
根据
| 100 |
| 44 |
| X |
| 8.8g |
| 73 |
| 44 |
| Y |
| 8.8g |
样品中CaCO3的质量分数为:
| 20g |
| 25g |
稀盐酸的溶质质量分数为:
| 14.6g |
| 146g |
解:设样品中CaCO3的质量为x,参加反应的稀盐酸中HCl的质量为y
CaCO3+2HCl=CaCl2+CO2↑+H2O
1007344
xy8.8g
根据
=
解得x=20 根据
=
解得y=14.6g
样品中CaCO3的质量分数为:
×100%=80%
稀盐酸的溶质质量分数为:
×100%=10%
.CaCO3+2HCl=CaCl2+CO2↑+H2O
1007344
xy8.8g
根据
| 100 |
| 44 |
| X |
| 8.8g |
| 73 |
| 44 |
| Y |
| 8.8g |
样品中CaCO3的质量分数为:
| 20g |
| 25g |
稀盐酸的溶质质量分数为:
| 14.6g |
| 146g |
2011年是国际化学年(IYC2011),其宗旨是“增进公众对化学重要性的认识,鼓励青年人热爱化学,学习和研究化学”.某校化学兴趣小组的同学,对课本中一氧化碳还原氧化铁实验作了绿色化改进后制取单质铁(K1,K2是活塞):
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物.

①这是关于气体的实验,实验前必须对装置进行装置的气密性检查;
②CO还原Fe2O3的化学方程式为
③在f处点燃气体的目的是
(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用.
①d瓶中应装
A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②该实验这样改进的主要优点是
(3)小刚用一种不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数.
小刚称取10g样品,利用上图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)
①由上表数据可分析出,反应后硬质玻璃管及所盛固体总质量减少的是
②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程).
解:设样品中氧化铁的质量为x
查看习题详情和答案>>
(1)关闭K1、开启K2,可以验证CO还原Fe2O3的产物.

①这是关于气体的实验,实验前必须对装置进行装置的气密性检查;
②CO还原Fe2O3的化学方程式为
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
;
| ||
③在f处点燃气体的目的是
点燃多余的一氧化碳,避免污染空气
点燃多余的一氧化碳,避免污染空气
.(2)关闭K2,开启K1,可以将e口出来的气体再从a通入装置而循环使用.
①d瓶中应装
D
D
(填序号).A.澄清石灰水 B.水 C.石蕊溶液 D.浓硫酸
②该实验这样改进的主要优点是
减少碳的排放,提高原料利用率
减少碳的排放,提高原料利用率
.(3)小刚用一种不纯的氧化铁粉末样品(杂质为铁粉),通过该实验测定样品中氧化铁的质量分数.
小刚称取10g样品,利用上图所示装置进行实验,相关实验数据见下表:(玻璃管内的物质完全反应)
| 编号 | 称量物 | 反应前 | 反映后 |
| 一 | 硬质玻璃管及所盛固体总质量 | 76.2g | 73.8g |
| 二 | C装置总质量 | 153.7g | 160.3g |
氧元素
氧元素
的质量.②请依据c装置总质量变化的数据,计算出样品中氧化铁的质量分数(写出计算过程).
解:设样品中氧化铁的质量为x
反应后生成二氧化碳的质量为:160.3g-153.7g=6.6g
3CO+Fe2O3
2Fe+3CO2
160 132
x 6.6g
=
x=8g
样品中氧化铁的质量分数为
×100%=80%
答:样品中氧化铁的质量分数为80%
3CO+Fe2O3
| ||
160 132
x 6.6g
| 160 |
| 132 |
| X |
| 6.6g |
样品中氧化铁的质量分数为
| 8g |
| 10g |
答:样品中氧化铁的质量分数为80%
反应后生成二氧化碳的质量为:160.3g-153.7g=6.6g
3CO+Fe2O3
2Fe+3CO2
160 132
x 6.6g
=
x=8g
样品中氧化铁的质量分数为
×100%=80%
答:样品中氧化铁的质量分数为80%
.3CO+Fe2O3
| ||
160 132
x 6.6g
| 160 |
| 132 |
| X |
| 6.6g |
样品中氧化铁的质量分数为
| 8g |
| 10g |
答:样品中氧化铁的质量分数为80%