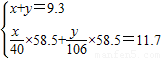题目内容
氢氧化钠固体常因吸收空气中的二氧化碳而变质.某研究性学习小组为探究氢氧化钠固体样品中的碳酸钠的质量分数(仅考虑样品为NaOH和Na2CO3的混合物),设计了多种实验方案,请结合以下方案回答有关问题:方案一:
称取一定量的氢氧化钠样品,加水溶解后,逐滴加入沉淀剂氢氧化钡溶液至不再产生沉淀为止.将沉淀过滤、洗涤、烘干、称量.
则:(1)沉淀洗涤的目的是
方案二:
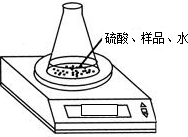
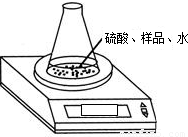
(2)利用下图装置测定氢氧化钠样品中 Na2CO3的质量分数,则必需的数据有:样品质量、反应前
 锥形瓶及其中各物质的总质量、
锥形瓶及其中各物质的总质量、方案三:
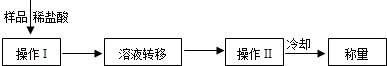
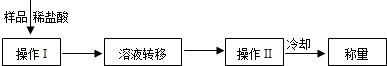
(3)操作Ⅰ中加入稀盐酸应过量的原因是
操作Ⅱ中需要的仪器有铁架台(含铁圈)、玻璃棒、酒精灯和
为计算碳酸钠的质量分数,小刚同学通过列二元一次方程组的办法得到两个表达式:
解:设样品中NaOH的质量为x,Na2CO3的质量为y.
|
请判断这两个方程组中是否存在问题,若有错误,请将纠正后的方程写在横线上:
经计算碳酸钠的质量分数为
分析:(1)根据在沉淀表面的可溶性杂质氢氧化钠;进行解答;若不洗涤,杂质氢氧化钠的质量当作沉淀物的质量,即样品中所含的碳酸根偏大;根据Ba2+ 的检验方法,进行分析解答;
(2)根据质量守恒定律:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;CO2逸出时会带有水蒸气; 进行分析解答;
(3)要使氢氧化钠样品中 的物质完全反应,必须加入过量稀盐酸;根据实验操作蒸发溶液时用的器皿为蒸发皿进行解答;分别计算出NaOH中钠元素的量,Na2CO3中钠元素的量,生成氯化钠的质量进行分析解答;根据Na2CO3的质量与样品的质量即可求出碳酸钠的质量分数.
(2)根据质量守恒定律:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;CO2逸出时会带有水蒸气; 进行分析解答;
(3)要使氢氧化钠样品中 的物质完全反应,必须加入过量稀盐酸;根据实验操作蒸发溶液时用的器皿为蒸发皿进行解答;分别计算出NaOH中钠元素的量,Na2CO3中钠元素的量,生成氯化钠的质量进行分析解答;根据Na2CO3的质量与样品的质量即可求出碳酸钠的质量分数.
解答:解:(1)因为在沉淀表面的可溶性杂质氢氧化钠,所以沉淀洗涤的目的是:除去沉淀表面的可溶性杂质;若不洗涤,杂质氢氧化钠的质量当作沉淀物的质量,即样品中所含的碳酸根偏大,导致碳酸钠的质量分数偏大;根据Ba2+ 的检验方法,滴加含有硫酸根的试剂即可,选用CuSO4;
故答案为:除去沉淀表面的可溶性杂质;偏大;CuSO4等;
(2)根据质量守恒定律:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;所以必需的数据有:样品质量、反应前锥形瓶及其中各物质的总质量、反应后锥形瓶及其中各物质的总质量;反应进行时,CO2逸出时会带有水蒸气;
故答案为:反应后锥形瓶及其中各物质的总质量;水蒸气会随CO2逸出;
(3)要使氢氧化钠样品中 的物质完全反应,必须加入过量稀盐酸;
NaOH中钠元素的量,生成氯化钠的质量为:
×58.5
Na2CO3中钠元素的量,生成氯化钠的质量为:2×
×58.5
设样品中NaOH的质量为x,Na2CO3的质量为y.
x+y=9.3g
×58.5+
×117=11.7 解得:x=4g;y=5.3g;
因此纠正后的方程为:
×58.5+
×117=11.7;
碳酸钠质量分数=
×100%=57%;
故答案为:使氢氧化钠、碳酸钠完全反应;蒸发皿;
×58.5+
×117=11.7; 57%.
故答案为:除去沉淀表面的可溶性杂质;偏大;CuSO4等;
(2)根据质量守恒定律:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和;所以必需的数据有:样品质量、反应前锥形瓶及其中各物质的总质量、反应后锥形瓶及其中各物质的总质量;反应进行时,CO2逸出时会带有水蒸气;
故答案为:反应后锥形瓶及其中各物质的总质量;水蒸气会随CO2逸出;
(3)要使氢氧化钠样品中 的物质完全反应,必须加入过量稀盐酸;
NaOH中钠元素的量,生成氯化钠的质量为:
| x |
| 40 |
Na2CO3中钠元素的量,生成氯化钠的质量为:2×
| y |
| 106 |
设样品中NaOH的质量为x,Na2CO3的质量为y.
x+y=9.3g
| x |
| 40 |
| y |
| 106 |
因此纠正后的方程为:
| x |
| 40 |
| y |
| 106 |
碳酸钠质量分数=
| 5.3 |
| 9.3 |
故答案为:使氢氧化钠、碳酸钠完全反应;蒸发皿;
| x |
| 40 |
| y |
| 106 |
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目
 锥形瓶及其中各物质的总质量、________.该方案有误差,请写出引起误差的一个原因:________.
锥形瓶及其中各物质的总质量、________.该方案有误差,请写出引起误差的一个原因:________.