网址:http://m.1010jiajiao.com/timu3_id_158820[举报]
①取稀盐酸和稀硝酸分别与石蕊试液作用
②向滴有石蕊的稀硫酸中加入NaOH溶液,并观察颜色
③向水中滴入石蕊试液
④向硫酸钠溶液中滴入石蕊试液
其中能证明是H+使石蕊变色的实验是
A.①和③结合 B.③和④结合 C.只②D.只①
 已知电石中含有的杂质与水反应会生成H2S和PH3气体,某校研究性学习小组设计实验测定电石样品的纯度.经查阅有关资料得知:H2S、PH3与硫酸铜溶液反应的化学方程式分别是:
已知电石中含有的杂质与水反应会生成H2S和PH3气体,某校研究性学习小组设计实验测定电石样品的纯度.经查阅有关资料得知:H2S、PH3与硫酸铜溶液反应的化学方程式分别是:H2S+CuSO4═CuS↓+H2SO4
19PH3+56CuSO4+44H2O═11H3PO4+56H2SO4+32Cu↓+8Cu3P↓
(1)甲组同学设计如图装置测定电石样品的纯度.试填空:
①写出实验中生成乙炔的化学反应方程式:
②电石充分反应后,在读数之前应
a.立即读数;b.调节量筒与广口瓶中液面相平;c.待气体充分冷却到室温.
(2)乙组同学认为甲组同学设计的实验测定结果精确度不高,建议使用如图装置进行实验:

试回答下列问题:
①E中发生反应的化学方程式为
②实验中需直接测定的数据有
a.电石样品的质量 b.装置C的增重 c.装置E的增重 d.实验时的室温和压强
③实验时,待B中充分反应后,应打开活塞使A中贮存的空气缓缓进入B中,其目的是
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,_______ 和_______是主要的去离子方法。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+。我国规定,Hg2+的排放标准不能超过0. 05 mg/L。若某工厂排放的废水1L中含 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为____________
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是海水中利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:

①阳离子交换膜是指____(填“A”或“B”)。②写出通电后阳极区的电极反应式____。
查看习题详情和答案>>
(共16分) ⑴现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
① 酸式滴定管用蒸馏水洗净后,还应该进行的操作是___▲___。
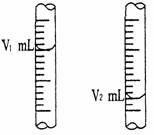 ② 右图是酸式滴定管中液面在滴定前后的读数:
② 右图是酸式滴定管中液面在滴定前后的读数:
试用有关符号表示该待测NaOH溶液的物质的量浓度:c (NaOH) = ___▲___ mol/L。
③ 若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏___▲___。
⑵已知空气中含有N2、O2、CO2、H2S等气体。试判断下列滴定操作的终点、分析出现下列现象的原因。(或用有关离子方程式表示)
① 以酚酞为指示剂,碱液滴定酸液,到 ▲ 为终点。30s后导致褪色的原因: ▲ 。
② 以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32—+I2 = S4O62—+2I—)到 ▲ 为终点,约5min后溶液又显色的原因: ▲ 。
查看习题详情和答案>>(12分)
(1)现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
① 酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
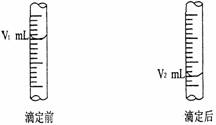 ② 右图是酸式滴定管中液面在滴定前后的读数:
② 右图是酸式滴定管中液面在滴定前后的读数:
试用有关符号表示该待测NaOH溶液的物质的量
浓度:c (NaOH) = _________________ mol/L。
③ 若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏_________________。
(2) 已知空气中含有N2、O2、CO2、H2S等气体。试判断下列滴定操作的终点、分析出现下列现象的原因。(或用有关离子方程式表示)
① 以酚酞为指示剂,用碱液滴定酸液到 为终点。约半分钟后导致褪色的原因: 。
② 以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32—+I2 = S4O62—+2I—)到 为终点,约5min后溶液又显色的原因: 。
查看习题详情和答案>>