网址:http://m.1010jiajiao.com/timu3_id_156181[举报]
(1)下列叙述正确的是( )
A.同周期元素中,ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,0族元素的单质都是气体
D.元素周期表中从ⅢB到ⅡB族这10个纵行的元素都是金属元素
(2)X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )
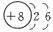
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.四种元素的单质中,Z单质的熔沸点最高
D.W的单质能与水反应,生成一种具有漂白性的物质
(3)铊(Tl)位于元素周期表的ⅢA族。有的同学预测:单质铊能与盐酸反应放出氢气,氢氧化铊是两性氢氧化物。你认为这位同学的预测正确吗?__________________________________________
查看习题详情和答案>>
| |||||||||||||||||||||||||||||||
| … | A | ||||||
| B | C | D |
(1)上述五种元素中电负性最大的是
(2)请写出E的电子排布式:
(3)A和D的氢化物中,沸点较高的是
(4)请写出B、C的最高价氧化物的水化物相混合反应的离子方程式:
(5)D和B形成的化合物的水溶液的pH
下表为元素周期表的一部分,请参照元素在表中的位置,回答下列问题(凡能用化学用语的必须用相应的化学用语回答):

(1)用原子符号表示中子数为8的编号为③的原子____,以上元素中原子的电子层数等于最外层电子数的元素为____,⑤、⑥、⑦、⑧三元素的简单离子半径由大到小的顺序为 。
(2)②①④三种元素能按原子个数比1:2:1形成一种在室内装修过程中常见的气体污染物。该气体分子的中心原子的杂化轨道类型为____,1mol该分子中π键的数目为____。
(3)写出⑥的单质在④的单质中燃烧产生的化合物的电子式 ,该化合物与足量⑨的低价硫酸盐溶液反应的离子方程式 。
(4)同主族元素的单质及化合物在许多性质上都存在着递变规律。下图是①、⑤、⑧、⑩的单质及①分别和⑤、⑧、⑩形成的化合物的键能大小。
由图中键能数据推断得知:①—R键(R表示⑤、⑧、⑩)的键能随分子中键长的增长而 (填“增大”或“减小”)。同主族元素随着原子序数的递增,非金属元素的单质分子中化学键的键长逐渐增大,键能____(填“一定减小”或“不一定减小”)根据图中键能数据,写出①的气态单质在⑧的气态单质中燃烧的热化学方程式____。

查看习题详情和答案>>

A.原子得到电子所放出的能量
B.原子半径的大小
C.原子逐个失去电子所吸收的能量
D.原子及形成不同分子的半径的大小
(2)分析同周期自左向右各元素原子的第一个数据:
①总体变化趋势是________(填“增大”或“减小”);
②与前后元素相比,由于该元素的数值增大较多而变得反常的元素位于元素周期表的某些族,分析它们的原子核外电子排布,指出造成上述反常情况的可能原因是______(填序号)。
A.它们的原子半径突然变小些
B.它们的核外电子排布处于饱和状态
C.它们的原子半径突然变大些
D.电子填充时,某些原子轨道达到半充满或全满时,体系稳定性提高
根据以上规律,请推测镁和铝的第一个数据的大小关系为:Mg(1)____Al(1)(填“>”或“<”或“=”)。
(3)每种元素的一组数据中个别地方增大的比例特别大,形成突跃(大幅度增大),请找出这些数据,并根据这些数据出现的规律,你认为氧元素出现该情况的数据应该是氧元素8个数据中的第______个。上述规律可以证明原子结构中____________________的结论。