摘要:解:C(Na2CO3)=0.5mol/L C(Na2SO4)=0.2mol/L
网址:http://m.1010jiajiao.com/timu3_id_155951[举报]
(2011?江西二模)已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法.请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①5min内,消耗N2的平均反应速率为
②下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol,下列说法正确的是
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
请回答:
①各物质的平衡浓度可能是
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:
(Ⅱ)a、b、c的关系:
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),此反应的△S
查看习题详情和答案>>
(1)450℃时,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol?L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
0.008mol.L-1
0.008mol.L-1
,此条件下该反应的化学平衡常数K=0.1(L/mol)2
0.1(L/mol)2
;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正<
<
v(N2)逆(填写“>”、“=”或“<”=).②下列各项能作为判断该反应达到化学平衡状态的依据是
CE
CE
(填序号字母)A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol,下列说法正确的是
BD
BD
.A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
①各物质的平衡浓度可能是
B
B
.A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:
0.1<a<0.3
0.1<a<0.3
.③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:
3a=b+0.3
3a=b+0.3
.(Ⅱ)a、b、c的关系:
c2/(a×b3)=0.1
c2/(a×b3)=0.1
.(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),此反应的△S
>
>
0(填“>”、“<”或“=”),△H=+1530kJ/mol
+1530kJ/mol
.(已知:H2的燃烧热为285.8kJ/mol)某小组为证明同温同压下,同浓度,同体积的酸性不同的两种二元酸与足量镁带反应时生成H2量相同而反应速率不同,装置如图.主要步骤如下:
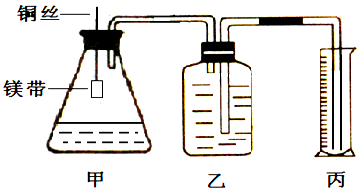
(1)配制浓度为0.5mol/L的硫酸和草酸溶液;
(2)用
(3)分别取去表面氧化膜的鎂带系于铜丝末端;
(4)检查装置气密性,乙中装满水,按图连接好装置;
(5)将铜丝下移,使足量鎂带浸如酸中(铜丝不与酸接触)至完全反应,同时记录
(6)反应结束时,读取量筒内水体积ymL.
将以上步骤补充完整并回答下列问题
(1)(4)中如何检查气密性
(2)用ρ=1.84 98.3%的浓硫酸配制250mL,c=0.5mol/L硫酸,主要仪器有
(3)读取量筒内水体积时,必须注意的问题是
(4)简述速率不等的原因
(5)此实验说明草酸为弱酸,请再设计一实验证明:
查看习题详情和答案>>

(1)配制浓度为0.5mol/L的硫酸和草酸溶液;
(2)用
酸式滴定管
酸式滴定管
量取10.00mL0.5mol/L的硫酸和草酸溶液分别加入两锥形瓶中;(3)分别取去表面氧化膜的鎂带系于铜丝末端;
(4)检查装置气密性,乙中装满水,按图连接好装置;
(5)将铜丝下移,使足量鎂带浸如酸中(铜丝不与酸接触)至完全反应,同时记录
反应所需时间
反应所需时间
;(6)反应结束时,读取量筒内水体积ymL.
将以上步骤补充完整并回答下列问题
(1)(4)中如何检查气密性
往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气.
往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气.
;(2)用ρ=1.84 98.3%的浓硫酸配制250mL,c=0.5mol/L硫酸,主要仪器有
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
、烧杯、玻璃棒、酸式滴定管等;(3)读取量筒内水体积时,必须注意的问题是
读数时保持乙丙中液面相平;待装置冷却至室温再读数
读数时保持乙丙中液面相平;待装置冷却至室温再读数
;(4)简述速率不等的原因
H+浓度不同
H+浓度不同
,铜丝不能与酸接触的原因与铜易形成原电池,加快反应速率,干扰实验测定
与铜易形成原电池,加快反应速率,干扰实验测定
;(5)此实验说明草酸为弱酸,请再设计一实验证明:
测定草酸钠溶液的PH,如大于7,则为弱酸
测定草酸钠溶液的PH,如大于7,则为弱酸
. 某校化学研究性学习小组欲设计实验验证Al、Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
某校化学研究性学习小组欲设计实验验证Al、Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
盐酸的浓度
盐酸的浓度
、溶液的温度
溶液的温度
相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为硫酸亚铁溶液(或其他的亚铁盐溶液)
硫酸亚铁溶液(或其他的亚铁盐溶液)
.(2)①若用Fe、Cu作电极设计成原电池,以确定Fe、Cu的活动性.试在下面方框中画出原电池装置图,标出原电池的电极材料和电解质溶液.
上述装置中正极反应式为
2H++2e-=H2↑或Cu2++2e-=Cu
2H++2e-=H2↑或Cu2++2e-=Cu
.②某小组同学采用Al、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用
D
D
.A.0.5mol?L-1氯化亚铁溶液 B.0.5mol?L-1氯化铜溶液
C.0.5mol?L-1盐酸 D.0.5mol?L-1氯化亚铁和0.5mol?L-1氯化铜混合溶液
(3)利用提供的试剂和用品:0.1mol?L-1盐酸溶液、0.1mol?L-1醋酸溶液、0.5mol?L-1氯化铝溶液、0.5mol?L-1氢氧化钠溶液、PH试纸.
请设计最简单实验证明氢氧化铝为弱碱
取适量的氯化铝溶液,用pH试纸测其pH值小于7,则证明氢氧化铝为弱碱
取适量的氯化铝溶液,用pH试纸测其pH值小于7,则证明氢氧化铝为弱碱
.