题目内容
(2011?江西二模)已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法.请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①5min内,消耗N2的平均反应速率为
②下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol,下列说法正确的是
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
请回答:
①各物质的平衡浓度可能是
A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:
(Ⅱ)a、b、c的关系:
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),此反应的△S
(1)450℃时,往一个2L的密闭容器中充入2.6mol H2和1mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol?L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
0.008mol.L-1
0.008mol.L-1
,此条件下该反应的化学平衡常数K=0.1(L/mol)2
0.1(L/mol)2
;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正<
<
v(N2)逆(填写“>”、“=”或“<”=).②下列各项能作为判断该反应达到化学平衡状态的依据是
CE
CE
(填序号字母)A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)=1.60mol,下列说法正确的是
BD
BD
.A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| N2 | H2 | NH3 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0.2 |
| 平衡浓度(mol/L) | a | b | c |
①各物质的平衡浓度可能是
B
B
.A.c=0.5mol/L B.b=0.5mol/L C.c=0.4mol/L D.a=0.3mol/L
②a的取值范围是:
0.1<a<0.3
0.1<a<0.3
.③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:
3a=b+0.3
3a=b+0.3
.(Ⅱ)a、b、c的关系:
c2/(a×b3)=0.1
c2/(a×b3)=0.1
.(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),此反应的△S
>
>
0(填“>”、“<”或“=”),△H=+1530kJ/mol
+1530kJ/mol
.(已知:H2的燃烧热为285.8kJ/mol)分析:(1)①根据化学平衡三段式计算,确定反应达到平衡各物质的变化量和反应达到化学平衡时各物质的浓度;进而计算速率和平衡常数;
②根据平衡状态的判断依据判断;只要满足正反应速率等于逆反应速率,即可判断;
③依据氢气增大的因素和平衡移动进行分析判断;
(2)依据极值转化,找到各物质的浓度范围进行分析判断;利用平衡常数计算分析abc的关系;
(3)依据熵变的含义结合反应中气体体积变化分析判断;依据盖斯定律进行分析计算,通过合并热化学方程式得到焓变;
②根据平衡状态的判断依据判断;只要满足正反应速率等于逆反应速率,即可判断;
③依据氢气增大的因素和平衡移动进行分析判断;
(2)依据极值转化,找到各物质的浓度范围进行分析判断;利用平衡常数计算分析abc的关系;
(3)依据熵变的含义结合反应中气体体积变化分析判断;依据盖斯定律进行分析计算,通过合并热化学方程式得到焓变;
解答:解:(1)①根据题意列式计算,从表中分析可知,20min时反应已达平衡,C(NH3)=0.20mol/L
根据反应 N2 +3H2
2NH3
初始浓度(mol/L):0.5 1.3 0
变化浓度(mol/L):0.1 0.3 0.2
平衡浓度(mol/L):0.4 1.0 0.2
5min内,氨气生成浓度为0.08mol/L,则氮气的消耗浓度为0.04mol/L;消耗N2的平均反应速率=
=0.008mol/L?min
K=
=
=0.1(L/mol)2
反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时氮气、氢气、氨气的浓度分别为:
0.4+1=1.4mol/L、1.0+1=2mol/L、0.2+1=1.2mol/L;计算浓度商
Q=
=
=0.13(L/mol)2
Q>K,平衡向逆向进行,v(N2)正<v(N2)逆
故答案为:0.008mol.L-1.min-1; 0.1;<
②A、是速率之比,反应过程中按照比例进行反应,故A不能判断该反应达到化学平衡状态;
B、按照速率之比等于系数之比,表述的是正反应速率,当某种物质的正反应速率和逆反应速率相等是表明反应达到平衡,所以当3v(N2)正=v(H2)逆 时反应达到平衡,故B不能判断该反应达到化学平衡状态;
C、反应是体积变化的反应,当容器内压强保持不变,说明反应达到平衡,故C能判断该反应达到化学平衡状态;
D、反应体系内质量守恒,体积一定,故混合气体的密度不变,所以混合气体的密度保持不变,不能说明反应达到平衡,故D不能判断该反应达到化学平衡状态;
E、此反应是反应前后气体体积改变的反应,容器内气体质量不变,气体总物质的量不变,容器内混合气体的平均分子量不变,能说明反应达到平衡,故E能判断该反应达到化学平衡状态;
故答案为:CE;
③若改变某一条件,达新平衡时n(H2)=1.60mol,说明氢气增大,可能是改变条件平衡逆向进行,增加氢气的量;
A、平衡不一定正向进行,增大氢气的量可以符合,故A错误;
B、可能是向容器中加入了一定量的H2气体,使氢气量增大,故B正确;
C、该反应是放热反应,降低了容器的温度,平衡向正反应方向进行,氢气的量减少,故C错误;
D、缩小容器的体积,相当于增大压强,平衡向气体体积减小的方向进行,该反应正向是气体体积减少的反应,所以缩小体积,平衡正向进行,氢气的量减少,但体积减小带来的浓度增大比平衡移动带来氢气的减少程度大,最终可以是氢气量增大,故D正确;
故答案为:CE;BD;
(2)依据平衡计算的方法列式讨论
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L) 0.2 0.3 0.2
变化量(mol/L)
平衡量(mol/L) a b c
反应正向进行则 0.1 0 0.4
反应逆向进行则 0.3 0.6 0
所以平衡时浓度的取值范围:0.1<a<0.3 0<b<0.6 0<c<0.4
①只有B符合;
②a的取值范围是0.1<a<0.3;
③利用极值转化进行计算
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L) 0.2 0.3 0.2
平衡量(mol/L) a b c
极值转化 a+0.5c b+1.5c 0
a+0.5c=0.2 b+1.5c=0.3;整理得
(Ⅰ)a与b的关系为 3a=b+0.3
(Ⅱ)a、b、c的关系 温度变化.平衡常数不变,K=0.1,根据平衡常数计算式代入得到:c2/(a×b3)=0.1
故答案为:①B; ②0.1<a<0.3; ③( I )3a=b+0.3;(Ⅱ)c2/(a×b3)=0.1;
(3)2N2(g)+6H2O(l)?4NH3(g)+3O2(g),此反应是气体体积增大的反应,所以是熵增大的反应,
故反应的△S>0;
①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;氢气的燃烧热285.8kJ/mol,反应的热化学方程式为②H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol
以上两热化学方程式消去氢气合并,①×2+②×6得到热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530kJ/mol
故答案为:>;+1530 kJ/mol.
根据反应 N2 +3H2
| ||
| △ |
初始浓度(mol/L):0.5 1.3 0
变化浓度(mol/L):0.1 0.3 0.2
平衡浓度(mol/L):0.4 1.0 0.2
5min内,氨气生成浓度为0.08mol/L,则氮气的消耗浓度为0.04mol/L;消耗N2的平均反应速率=
| 0.04mol/L |
| 5min |
=0.008mol/L?min
K=
| [NH3]2 |
| [N2]?[H2]3 |
| 0.22 |
| 0.4×1.03 |
反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时氮气、氢气、氨气的浓度分别为:
0.4+1=1.4mol/L、1.0+1=2mol/L、0.2+1=1.2mol/L;计算浓度商
Q=
| C2(NH3) |
| C(N2)×C3(H2) |
| 1.22 |
| 1.4×23 |
Q>K,平衡向逆向进行,v(N2)正<v(N2)逆
故答案为:0.008mol.L-1.min-1; 0.1;<
②A、是速率之比,反应过程中按照比例进行反应,故A不能判断该反应达到化学平衡状态;
B、按照速率之比等于系数之比,表述的是正反应速率,当某种物质的正反应速率和逆反应速率相等是表明反应达到平衡,所以当3v(N2)正=v(H2)逆 时反应达到平衡,故B不能判断该反应达到化学平衡状态;
C、反应是体积变化的反应,当容器内压强保持不变,说明反应达到平衡,故C能判断该反应达到化学平衡状态;
D、反应体系内质量守恒,体积一定,故混合气体的密度不变,所以混合气体的密度保持不变,不能说明反应达到平衡,故D不能判断该反应达到化学平衡状态;
E、此反应是反应前后气体体积改变的反应,容器内气体质量不变,气体总物质的量不变,容器内混合气体的平均分子量不变,能说明反应达到平衡,故E能判断该反应达到化学平衡状态;
故答案为:CE;
③若改变某一条件,达新平衡时n(H2)=1.60mol,说明氢气增大,可能是改变条件平衡逆向进行,增加氢气的量;
A、平衡不一定正向进行,增大氢气的量可以符合,故A错误;
B、可能是向容器中加入了一定量的H2气体,使氢气量增大,故B正确;
C、该反应是放热反应,降低了容器的温度,平衡向正反应方向进行,氢气的量减少,故C错误;
D、缩小容器的体积,相当于增大压强,平衡向气体体积减小的方向进行,该反应正向是气体体积减少的反应,所以缩小体积,平衡正向进行,氢气的量减少,但体积减小带来的浓度增大比平衡移动带来氢气的减少程度大,最终可以是氢气量增大,故D正确;
故答案为:CE;BD;
(2)依据平衡计算的方法列式讨论
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L) 0.2 0.3 0.2
变化量(mol/L)
平衡量(mol/L) a b c
反应正向进行则 0.1 0 0.4
反应逆向进行则 0.3 0.6 0
所以平衡时浓度的取值范围:0.1<a<0.3 0<b<0.6 0<c<0.4
①只有B符合;
②a的取值范围是0.1<a<0.3;
③利用极值转化进行计算
N2(g)+3H2(g)?2NH3(g)
起始量(mol/L) 0.2 0.3 0.2
平衡量(mol/L) a b c
极值转化 a+0.5c b+1.5c 0
a+0.5c=0.2 b+1.5c=0.3;整理得
(Ⅰ)a与b的关系为 3a=b+0.3
(Ⅱ)a、b、c的关系 温度变化.平衡常数不变,K=0.1,根据平衡常数计算式代入得到:c2/(a×b3)=0.1
故答案为:①B; ②0.1<a<0.3; ③( I )3a=b+0.3;(Ⅱ)c2/(a×b3)=0.1;
(3)2N2(g)+6H2O(l)?4NH3(g)+3O2(g),此反应是气体体积增大的反应,所以是熵增大的反应,
故反应的△S>0;
①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;氢气的燃烧热285.8kJ/mol,反应的热化学方程式为②H2(g)+
| 1 |
| 2 |
以上两热化学方程式消去氢气合并,①×2+②×6得到热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530kJ/mol
故答案为:>;+1530 kJ/mol.
点评:本题考查了化学平衡的计算,速率、平衡常数的计算,平衡状态的判断依据和方法,影响平衡的因素分析,盖斯定律的应用,关键是极值法在化学平衡中的应用,题目综合性强,较难.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
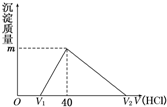 (2011?江西二模)将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )
(2011?江西二模)将一定量的钠铝合金置于水中,合金全部溶解,得到20mL OH-浓度为1mol/L的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是( )