摘要:23题图23.所示装置中.烧瓶内充满干燥气体a.将胶滴管内液体b挤入烧瓶内.轻轻振荡烧瓶.然后将水止夹C打开.烧杯内液体b呈喷泉状喷出.烧瓶中形成白色浑浊液体.最终几乎充满烧瓶.则a.b不可能是 ,请分析其理由(要求写化学方程式简析原因). . A.CO22溶液 B.SO2(g).HNO3和Ba(NO3)2溶液 C.SO22溶液 D.HCl(g).AgNO3溶液
网址:http://m.1010jiajiao.com/timu3_id_155279[举报]
进行中和热的测定的装置如图所示.回答下列问题:
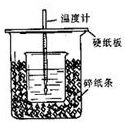
(1)从实验装置中尚缺少的一种玻璃用品是
(2)烧杯间填满碎纸条的作用是
(3)利用该装置测得的中和热数值
(4)某研究小组将装置完善后,把V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:

①研究小组做该实验时环境温度
②由题干及图形可知,V1/V2=
查看习题详情和答案>>

(1)从实验装置中尚缺少的一种玻璃用品是
环形玻璃搅拌器
环形玻璃搅拌器
.(2)烧杯间填满碎纸条的作用是
减少实验过程中的热量损失
减少实验过程中的热量损失
.(3)利用该装置测得的中和热数值
偏小
偏小
(填“偏大、偏小、无影响”)(4)某研究小组将装置完善后,把V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:

①研究小组做该实验时环境温度
低于
低于
(填“高于”、“低于”或“等于”)22℃.②由题干及图形可知,V1/V2=
3:2
3:2
时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为1.5
1.5
mol/L. 为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低.
为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低.回答下列问题:
(1)写出锌和稀硫酸反应的化学方程式:
Zn+H2SO4=ZnSO4+H2 ↑
Zn+H2SO4=ZnSO4+H2 ↑
.(2)如果发生反应的锌片质量为0.260克,实验测得生成的氢气体积为92mL,则这时的气体摩尔体积为
23.0
23.0
L?mol-1.(3)如果甲管的刻度最大值是100mL,则实验中称取锌片的最大质量是
0.283
0.283
克.(4)为了准确地测量H2的体积,在读取反应后甲管中液面的读数时,应注意
ABC
ABC
(填写序号).A.视线与凹液面最低处相平
B.等待片刻,待乙管液面不再上升时读数
C.读数时应上、下移动乙管,使甲、乙两管液面相平
D.读数不一定使甲、乙两管液面相平.
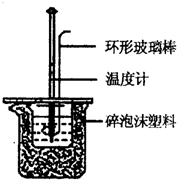 实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)实验时用环形玻璃棒搅拌溶液的方法是
上下搅动
上下搅动
,不能用铜丝搅拌棒代替环形玻璃棒的理由是铜传热快,防止热量损失
铜传热快,防止热量损失
.(2)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=
-56.8kJ/mol
-56.8kJ/mol
[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混,合溶液的比热容(c)按4.18J/(g?℃)计算].(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1,则△H1与△H的关系为:△H1
>
>
△H(填“<”、“>”或“=”),理由是NH3?H2O电离吸热
NH3?H2O电离吸热
. 实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是
Cu传热快,热量损失大
Cu传热快,热量损失大
.(2)在操作正确的前提下,提高中和热测定准确性的关键是:
提高装置的保温效果
提高装置的保温效果
.(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=
-56.8 kJ?mol-1
-56.8 kJ?mol-1
[盐酸和NaOH溶液的密度按1g?cm-3计算,反应后混合溶液的比热容(c)按4.18J?(g?℃)-1计算].如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将偏 大
偏 大
(填“偏大”、“偏小”、“不变”).(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
ABDF
ABDF
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
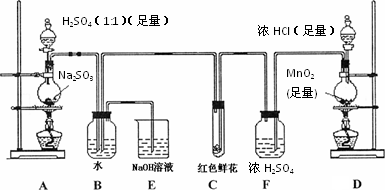
回答下列问题
(1)写出A装置中玻璃仪器的名称:酒精灯、___________________.
(2)实验开始后,写出B中反应的离子方程式___________________.
(3)C中的现象是___________,E装置的作用是___________________.
(4)按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应.然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3 g,则原样品中Na2SO3的纯度为________(精确到0.1%).
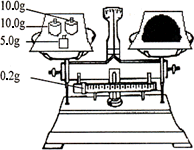
(5)在过滤沉淀时若过滤液出现浑浊,则必须要重复操作,若该学生没有重复过滤,则测定的结果将________(填偏高、偏低或无影响).
(6)要使测定结果准确,①装置气密性必须良好;②应先点燃________处酒精灯(填装置字母).