摘要:ZnCl2样品中含有CuCl2杂质.称取该样的29.89g溶于水配成100mL溶液.然后向此溶液中加入一定量纯锌片完全反应后耗去1.30g锌.求原溶液中Cl-离子的物质的量浓度. [素质优化训练]
网址:http://m.1010jiajiao.com/timu3_id_155205[举报]
(2013?无锡一模)信息时代产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到主要含Cu、Al及少量Fe、Au、Pt等金属的混合物,设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
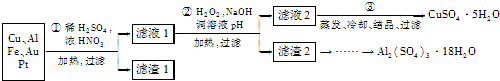
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)第①步操作前需将金属混合物进行粉碎,其目的是
(2)某学生认为用H2O2代替浓HNO3更好,理由是
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式:
(3)第②步中应将溶液pH调至
(4)由滤渣2制取Al2(SO4)3?18H2O,探究小组设计了两种方案:
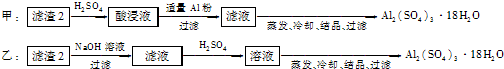
你认为
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.100 0mol?L-1Na2S2O3标准溶液滴定至终点,共消耗14.00mL Na2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2S2O
+I2═2I-+S4O
①样品中硫酸铜晶体的质量分数为
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是
查看习题详情和答案>>

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 5.8 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 8.8 | 3.2 | 5.2 | 6.7 |
(1)第①步操作前需将金属混合物进行粉碎,其目的是
增大金属和酸的接触面积,加快反应速率
增大金属和酸的接触面积,加快反应速率
.(2)某学生认为用H2O2代替浓HNO3更好,理由是
不产生对环境有污染的气体
不产生对环境有污染的气体
;请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式:
Cu+H2O2+2H+═Cu2++2H2O
Cu+H2O2+2H+═Cu2++2H2O
.(3)第②步中应将溶液pH调至
5.2~5.4
5.2~5.4
.(4)由滤渣2制取Al2(SO4)3?18H2O,探究小组设计了两种方案:

你认为
甲
甲
种方案为最佳方案,理由是甲得到产品纯度高
甲得到产品纯度高
、原子利用率高
原子利用率高
.(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.100 0mol?L-1Na2S2O3标准溶液滴定至终点,共消耗14.00mL Na2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2S2O
2- 3 |
2- 6 |
①样品中硫酸铜晶体的质量分数为
87.5%
87.5%
.②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是
样品中含有Na2SO4等杂质
样品中含有Na2SO4等杂质
.某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验过程(实验前已经将合金样品磨成粉末状)
(1)称取样品ag,所用称量仪器使用的第一步操作为
(2)将上述样品溶解于足量稀盐酸中,过滤,滤渣中含有
(3)在滤液中加过量NaOH溶液,过滤.
(4)在第(3)步的滤液中通入足量的CO2,充分反应后过滤,将沉淀用蒸馏水洗涤数次后,烘干灼烧至质量不再减少为止.冷却后称量,质量为bg.有关反应的离子方程式为
×100%
×100%.
(5)①若步骤(3)中NaOH溶液的量加入不足,则能使测定结果
②若步骤(4)中沉淀没有洗涤,则能使测定结果
查看习题详情和答案>>
(1)称取样品ag,所用称量仪器使用的第一步操作为
游码置零,调节天平平衡
游码置零,调节天平平衡
.(2)将上述样品溶解于足量稀盐酸中,过滤,滤渣中含有
Cu、Si
Cu、Si
.(3)在滤液中加过量NaOH溶液,过滤.
(4)在第(3)步的滤液中通入足量的CO2,充分反应后过滤,将沉淀用蒸馏水洗涤数次后,烘干灼烧至质量不再减少为止.冷却后称量,质量为bg.有关反应的离子方程式为
CO2+H20+A102-═Al(OH)3↓+HCO3-、2Al(OH)3↓
Al2O3+3H2O
| ||
CO2+H20+A102-═Al(OH)3↓+HCO3-、2Al(OH)3↓
Al2O3+3H2O
,该样品中铝的质量分数为
| ||
| 9b |
| 17a |
| 9b |
| 17a |
(5)①若步骤(3)中NaOH溶液的量加入不足,则能使测定结果
偏低
偏低
(填“偏高”、“偏低”或“不影响”,下同).②若步骤(4)中沉淀没有洗涤,则能使测定结果
偏高
偏高
.13.5g CuCl2样品中含有下列某一种盐类杂质,当与足量AgNO3溶液充分反应后,得到沉淀29g,则样品中混有的杂质是
[ ]
A.ZnCl2
B.KCl
C.BaCl2
D.MgCl2
13.5克氯化铜样品中含有下列某一种盐类杂质,当与足量AgNO3溶液充分反应后,得到AgCl沉淀29克,则样品中混有杂质是
[ ]
A.ZnCl2
B.KCl
C.BaCl2
D.MgCl2
氮化铝(AlN)是一种新型的无机材料,广泛应用于集成电路生产领域.某氮化铝样品中含有碳或氧化铝杂质,现用图I装置进行实验,使氮化铝样品与NaOH溶液反应(反应的化学方程式为AlN+NaOH+H2O═NaAlO2+NH3↑),根据反应所生成的氨气的体积来测定样品中氮化铝的质量分数,并根据实验现象确定杂质的成分.实验过程记录如下:

a.检查装置的气密性;
b.往图I装置的锥形瓶中放入适量氮化铝样品,从分液漏斗往锥形瓶中加入过量浓NaOH溶液,立即发生剧烈反应,生成的氨将广口瓶中的水排入量筒中;
c.实验结束后,测量量筒中收集到的水的体积(包括由广口瓶到量筒的导管内的水柱的体积),进行计算.
(1)检査A装置气密性的方法是
(2)B装置广口瓶中的试剂X宜选用 (填下列选项字母)
A.汽油 B.酒精 C.植物油 D.四氯化碳
(3)B装置广口瓶中的液体没有装满(上方留有少量空间),实验结果测得的NH3的体积将 .(填“偏大”、“偏小”或“无影响”).
(4)实验结束后,若观察到A装置锥形瓶中还有固体,则样品中含有的杂质是 .
(5)若称取wg样品进行实验,实验完成时测得氨气的体积为aL(已折算成标准状况),则样品中AlN的质量分数为 (用含w、a的关系式表示,不用化简).
(6)有人改用上图D装置进行同样实验,通过测定E装置增加的质量来确定样品中AlN的质量分数.你认为两种实验方案中 更好(填“图I”或“图Ⅱ”).理由是 .
查看习题详情和答案>>

a.检查装置的气密性;
b.往图I装置的锥形瓶中放入适量氮化铝样品,从分液漏斗往锥形瓶中加入过量浓NaOH溶液,立即发生剧烈反应,生成的氨将广口瓶中的水排入量筒中;
c.实验结束后,测量量筒中收集到的水的体积(包括由广口瓶到量筒的导管内的水柱的体积),进行计算.
(1)检査A装置气密性的方法是
(2)B装置广口瓶中的试剂X宜选用
A.汽油 B.酒精 C.植物油 D.四氯化碳
(3)B装置广口瓶中的液体没有装满(上方留有少量空间),实验结果测得的NH3的体积将
(4)实验结束后,若观察到A装置锥形瓶中还有固体,则样品中含有的杂质是
(5)若称取wg样品进行实验,实验完成时测得氨气的体积为aL(已折算成标准状况),则样品中AlN的质量分数为
(6)有人改用上图D装置进行同样实验,通过测定E装置增加的质量来确定样品中AlN的质量分数.你认为两种实验方案中