题目内容
(2013?无锡一模)信息时代产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到主要含Cu、Al及少量Fe、Au、Pt等金属的混合物,设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
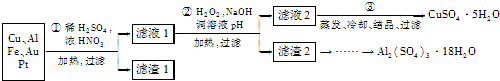
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)第①步操作前需将金属混合物进行粉碎,其目的是
(2)某学生认为用H2O2代替浓HNO3更好,理由是
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式:
(3)第②步中应将溶液pH调至
(4)由滤渣2制取Al2(SO4)3?18H2O,探究小组设计了两种方案:
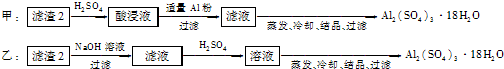
你认为
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.100 0mol?L-1Na2S2O3标准溶液滴定至终点,共消耗14.00mL Na2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2S2O
+I2═2I-+S4O
①样品中硫酸铜晶体的质量分数为
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 5.8 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 8.8 | 3.2 | 5.2 | 6.7 |
(1)第①步操作前需将金属混合物进行粉碎,其目的是
增大金属和酸的接触面积,加快反应速率
增大金属和酸的接触面积,加快反应速率
.(2)某学生认为用H2O2代替浓HNO3更好,理由是
不产生对环境有污染的气体
不产生对环境有污染的气体
;请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式:
Cu+H2O2+2H+═Cu2++2H2O
Cu+H2O2+2H+═Cu2++2H2O
.(3)第②步中应将溶液pH调至
5.2~5.4
5.2~5.4
.(4)由滤渣2制取Al2(SO4)3?18H2O,探究小组设计了两种方案:

你认为
甲
甲
种方案为最佳方案,理由是甲得到产品纯度高
甲得到产品纯度高
、原子利用率高
原子利用率高
.(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.100 0mol?L-1Na2S2O3标准溶液滴定至终点,共消耗14.00mL Na2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2S2O
2- 3 |
2- 6 |
①样品中硫酸铜晶体的质量分数为
87.5%
87.5%
.②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是
样品中含有Na2SO4等杂质
样品中含有Na2SO4等杂质
.分析:(1)将金属混合物进行粉碎增大固体接触面积增大反应速率;
(2)过氧化氢做氧化剂被还原为水,产物无污染,硝酸做氧化剂会被还原生成氮氧化物污染空气;铜在酸溶液中被过氧化氢氧化为铜离子,本身被还原为水,依据原子守恒、电荷守恒配平写出离子方程式;
(3)依据流程分析加入氧化剂氧化亚铁离子为铁离子后,加入氢氧化钠调节溶液PH使铁离子和铝离子全部沉淀,铜离子不沉淀;
(4)滤渣2的成分为氢氧化铁和氢氧化铝,依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(5)①依据滴定实验发生的反应的定量关系进行计算样品中所含铜离子物质的量,结合元素守恒计算硫酸铜 晶体质量分数;
②样品中含有硫酸钠,测定硫酸根离子含量不能计算得到硫酸铜晶体的含量;
(2)过氧化氢做氧化剂被还原为水,产物无污染,硝酸做氧化剂会被还原生成氮氧化物污染空气;铜在酸溶液中被过氧化氢氧化为铜离子,本身被还原为水,依据原子守恒、电荷守恒配平写出离子方程式;
(3)依据流程分析加入氧化剂氧化亚铁离子为铁离子后,加入氢氧化钠调节溶液PH使铁离子和铝离子全部沉淀,铜离子不沉淀;
(4)滤渣2的成分为氢氧化铁和氢氧化铝,依据实验方案过程分析制备晶体中是否含有杂质,使用的试剂作用,原料的利用率,原子利用率因素分析判断;
(5)①依据滴定实验发生的反应的定量关系进行计算样品中所含铜离子物质的量,结合元素守恒计算硫酸铜 晶体质量分数;
②样品中含有硫酸钠,测定硫酸根离子含量不能计算得到硫酸铜晶体的含量;
解答:解:(1)第①步操作前需将金属混合物进行粉碎,其目的是增大固体与酸的接触面积增大反应速率;
故答案为:增大金属和酸的接触面积,加快反应速率;
(2)过氧化氢做氧化剂被还原为水,产物无污染,硝酸做氧化剂会被还原生成氮氧化物污染空气;铜在酸溶液中被过氧化氢氧化为铜离子,本身被还原为水,反应的离子方程式为:Cu+H2O2+2H+═Cu2++2H2O;
故答案为:不产生对环境有污染的气体; Cu+H2O2+2H+═Cu2++2H2O;
(3)加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀,依据图表数据分析可知,溶液PH调节为5.2~5.4,使Fe3+和Al3+形成沉淀,铜离子不沉淀,所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;故答案为:5.2~5.4;
(4)制备硫酸铝晶体的甲、乙两种方法中,甲方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;乙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案甲最合理,因为乙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以上述两种方案中:从原子利用率和是否产生杂质考虑知,甲方案更合理,
故答案为:甲; 甲得到产品纯度高、原子利用率高;
(5)①2Cu2++4I-═2CuI(白色)↓+I2 2S2O
+I2═2I-+S4O
反应的定量关系为2Cu2+~I2 ~2S2O32-
1.4×10-3mol 0.100 0mol?L-1×0.014.00L=1.4×10-3mol
100ml溶液中含硫酸铜晶体物质的量为1.4×10-2mol,所以硫酸铜晶体的质量分数=
×100%=87.5%;
故答案为:87.5%;
②依据流程分析判断,样品中含有硫酸钠,不能通过测定硫酸根离子的方法计算得到硫酸铜晶体的质量分数;
故答案为:样品中含有Na2SO4等杂质;
故答案为:增大金属和酸的接触面积,加快反应速率;
(2)过氧化氢做氧化剂被还原为水,产物无污染,硝酸做氧化剂会被还原生成氮氧化物污染空气;铜在酸溶液中被过氧化氢氧化为铜离子,本身被还原为水,反应的离子方程式为:Cu+H2O2+2H+═Cu2++2H2O;
故答案为:不产生对环境有污染的气体; Cu+H2O2+2H+═Cu2++2H2O;
(3)加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染.调溶液PH的目的是使Fe3+和Al3+形成沉淀,依据图表数据分析可知,溶液PH调节为5.2~5.4,使Fe3+和Al3+形成沉淀,铜离子不沉淀,所以滤液2的成分是Cu2+,滤渣2的成分为氢氧化铁和氢氧化铝;故答案为:5.2~5.4;
(4)制备硫酸铝晶体的甲、乙两种方法中,甲方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;乙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案甲最合理,因为乙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以上述两种方案中:从原子利用率和是否产生杂质考虑知,甲方案更合理,
故答案为:甲; 甲得到产品纯度高、原子利用率高;
(5)①2Cu2++4I-═2CuI(白色)↓+I2 2S2O
2- 3 |
2- 6 |
反应的定量关系为2Cu2+~I2 ~2S2O32-
1.4×10-3mol 0.100 0mol?L-1×0.014.00L=1.4×10-3mol
100ml溶液中含硫酸铜晶体物质的量为1.4×10-2mol,所以硫酸铜晶体的质量分数=
| 1.4×10-2mol×250g/mol |
| 4.0g |
故答案为:87.5%;
②依据流程分析判断,样品中含有硫酸钠,不能通过测定硫酸根离子的方法计算得到硫酸铜晶体的质量分数;
故答案为:样品中含有Na2SO4等杂质;
点评:本题考查了铜铁铝及其化合物的分离方法和流程分析判断,试剂选择的方法应用,离子分离的过程分析和计算,题目难度中等.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
