网址:http://m.1010jiajiao.com/timu3_id_152100[举报]
 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.(1)B的单质晶体为体心立方堆积模型,其配位数为
(2)试比较B、D分别与E形成的化合物的熔点高低并说明理由
(3)A、G形成某种化合物的晶胞结构如图所示.若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为
(4)在1.0l×105 Pa、t1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式)
(1)写出下列元素的名称:B:_____________,C:_____________,D:_____________。
(2)写出乙的电子式:___________,丁属于___________分子(填“极性”或“非极性”),丙的空间构型为___________。
(3)向20mL 0.1 mol·L-1丙的水溶液中加入等体积的pH=1的H2SO4,则所得溶液中各离子浓度由大到小的排列顺序为___________,n(![]() )+n(H+)-n(OH-)=___________mol。
)+n(H+)-n(OH-)=___________mol。
(4)戊是结晶水合物,由五种元素组成(其中四种为A、C、D、E),常用作净水剂,用离子方程式表示其净水原理___________。在戊的水溶液中逐渐滴入稀Ba(OH)2溶液直至过量。下列表示加入Ba(OH)2溶液的体积(X)与溶液中沉淀的物质的量(Y)的关系示意图中,正确的是___________。

已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为 ;E元素的最高价氧化物分子的立体构型是 。F元素原子的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由 。
(3)A、G形成某种化合物的晶胞结构如图所示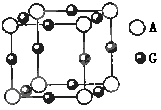 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a
g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a
g/cm3,其晶胞的边长为 cm。
(4)在1.0l×105 Pa、t1℃时,气体摩尔体积为53.4 L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式) 。
查看习题详情和答案>>
(1)B的单质晶体为体心立方堆积模型,其配位数为 ;E元素的最高价氧化物分子的立体构型是 。F元素原子的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由 。
(3)A、G形成某种化合物的晶胞结构如图所示
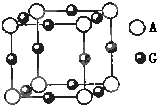 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。(4)在1.0l×105 Pa、t1℃时,气体摩尔体积为53.4 L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式) 。
(1)写出D2C2的电子式:


(2)我国普遍采用一种方法制得含有A、C、E三种元素的某重要化工产品,其工业生成的第一步化学反应方程式为
| ||
| ||
(3)均由A、C、D、E四种元素组成的两种物质在溶液中反应的离子方程式为
(4)由A与C两种元素组成的一种化合物能使酸性高锰酸钾褪色,反应的离子方程式是
(5)单质B可与由A、C、E 三种元素组成的化合物在一定条件下反应生成EC2,该反应的化学方程式为
| ||
| ||
(6)B元素的氢化物有多种,1molB的某种氢化物中含有14mol电子,已知在25℃,101kPa下,1g该气态氢化物在足量氧气中完全燃烧生成液态水时放出热量为50kJ,写出该物质燃烧热的热化学方程式
| 5 |
| 2 |
| 5 |
| 2 |