摘要:1 某超重元素的原子符号为277112R .在这种原子中中子数与电子数之差为: A 46 B 53 C 165 D 112 2 位于周期表的ⅡA族和 ⅢA族的元素.原子序数的差不可能是 A 1 B 11 C 10 D 25 3 在化学反应中.下列数据会发生变化的是 A 电子数 B 质子数 C 中子数 D 质量数 4 下列各组物质中.互为同位素的是: A 金刚石与石墨 B水与重水 C纯碱与烧碱 D 氕与氘 5 下列物质中既含离子键又含非极性键的是: A KOH B Na2O C Na2O2 D H2O 6 下列物质的熔点最高的是: A NaF B NaI C 冰 D 干冰 7 含有相同 质子数的微粒一定是: A 同一种元素B 同一种原子 C 同一种分子 D 不能确定 8 在核电荷数为1--20的元素的原子中. 次外层电子数为最外层电子数2倍的元素有: A 1种 B 2种 C 3种 D 4种 9 下列化合物中阳离子与阴离子半径比值最小的是: A NaF B MgI2 C BaI2 D KBr 10 下列各组原子序数的两种元素能形成AB2型离子化合物的是: A 6和8 B 11和13 C 11和6 D 12和17 11 X.Y.Z三种元素在周期表中.X.Y同主族.Y.Z同周期.它们的原子的最外层电子数之和为16.则这三种元素可能是: A Na.K.Ca B N.P.S C F.Br.Al D O.S.Cl 12 下列哪种元素的原子在形成化合物时形成化学键种类最多: A Na B Ne C Cl D C 13 根据元素周期表推测第八周期最多可填满多少种元素 A 32 B 50 C 68 D 72 14下列说法中错误的是: A 原子及其阴离子的核外电子层数等于该元素所在的周期数 B 周期表中从ⅢB族10个纵行的元素都是金属元素 C除氦外的稀有气体原子的最外层电子数都是8 D 同种元素的各种同位素形成的单质的物理性质.化学性质都相同 15 短周期元素X.Y可形成化合物X2Y3.若已知Y的原子序数为m.则X的原子序数不可能的是: A m +6 B m +3 C m -3 D m -11 16NA为阿佛加德罗常数.2克重氢分子中电子数为: A NA B 1/2NA C 1/4NA D 2NA 17 元素X的一种核素abX.元素Y的一种核素为cdY.已知a>c.b>d.则元素X和Y的相对原子质量的关系为 A X>Y B X<Y C X=Y D 不能确定 18 下列性质中.可以证明其化合物内一定存在离子键的是: A 可溶于水 B 具有较高的熔点 C 水溶液能导电 D 熔融状态能导 19 硼有两种天然同位素105B.115B.硼元素的近似相对原子质量为10.8.下列对硼元素中105B的质量分数的判断中正确的是: A 20% B >20% C <20% D 80% 20 下列分子中所有原子都满足最外层有8个电子结构的是: A COCl2 B SF6 C XeO2 D BF3 21 1999年曾报道合成和分离出含高能量的正离子N5+ 的化合物N5AsF6 .下列叙述错误的是: A N5+正离子共有34个核外电子 B N5+中氮原子间以共用电子对结合 C 化合物N5AsF6中As化合价为+1 D 化合物N5AsF6中F化合价为-1 22 下列说法正确的是: A 含有共价键的化合物一定是共价化合物 B 分子中只有极性键的物质一定是共价化合物 C 非极性键不能存在于化合物中 D 只有非金属原子间才能形成共价键 23 X-.Y+.Z2-.W-四种离子的电子层数为n或n-1.离子半径为Z2->W->X->Y+ .则四种元素的质子数为: A W>Z>Y>X B Z>W>Y>X C X>Y>Z>W D X>Y>W>Z 24 M.N两种元素的原子.当它们获得两个电子形成稀有气体元素的电子层结构的离子时.M放出的能量大于N.那么可知: A M单质的氧化性比N强 B M单质的还原性比N强 C N2- 还原性比M2- 弱 D M 原子半径比N原子半径大 25 R1.R2为元素R的两种同位素.相对原子质量分别为M1.M2.原子个数百分比分别为X1.X2.若R为一价主族元素.则R的硝酸盐的相对分子质量为: A M1X1+M2X2 B (M1+M2)/2 +62 C (M1 +M2)(X1 +X2)+62 D M1X1 +M2X2 +62 第二卷 26 3.7克某核素的一种微粒3717R-中.中子数约有① mol.电子数约有② mol. 27 某原子的原子序数为53 .该元素位于周期表中第①周期的第②族. D A B C E 28 在周期表有五种元素.它们在周期表的位置如右图所示. 已知它们的最外层电子数之和为30.且原子序数最大的不超过36.试回答: ⑴A在元素周期表里的位置是① 周期② 族. ⑵E的元素符号是③ . ⑶B的 ④ 较⑤ 为弱.较⑥ 为强. ⑷B的最高价氧化物的水化物分子式是⑦ .其酸性较⑧ 为强.较⑨ 为弱. ⑸B单质与C单质比较其 较为 .实验依据是 . 29 有X.Y.Z三种元素的原子序数依次增大.且位于同一周期.价电子数之和为10.它们的最高价氧化物的水化物之间任意两种都能反应生成盐和水.M元素与上述三种元素位于相邻的周期.面M原子的L电子 有4个电子 .回答下列问题: ⑴X.Y.Z.M的元素符号分别为X ①.Y ②.Z ③.M ④ . ⑵Y位于元素周期表的第⑤ 周期第⑥ 族. ⑶Z原子的结构示意图为:⑦ . ⑷X单质跟水反应的离子方程式是⑧ . 30 写出下列化合物的电子式:CO2① HClO② NaF③ 31 原子序数大于4的主族元素.X.Y的离子Xm+.Yn-它们的核外电子排布相同.据此推断:X和 Y所属周期数之差为① .X和Y的核电荷数之差为② .Y和X的族序数之差为③ . 32 A+.B+.C-.D.E五种微粒.都含有10个电子.已知①A+ +C-=D +E↑ ②B+ +C-=2D.请回答:⑴C-离子的电子式是① .⑵分别写出A+和D反应.B+和E反应的离子反应方程式② .③. 33 化合物A是一种不稳定的物质.它的分子组成可用OxFy表示.10ml该气体能分解生成15mlO2和10mlF2.⑴A的化学式是① 推断的依据是② ⑵已知A分子中x个氧原子呈-O─O─O-链状排列.则A分子的电子式是③ 结构式是④ 34 A.B.C.D 4种短周期元素的原子序数依次增大.A.D同族.B.C同周期.A.B组成的化合物甲为气态.其中A.B的原子数之比为4:1.由A.C组成的两种化合物乙和丙都是液体.乙中A.C原子数比为1:1.丙中A.C原子数比为2:1.由D.C组成的两种丁化合物和戊都为固态.丁中D.C原子数比为1:1.戊中则为2:1. ⑴写出甲.乙.丙.丁.戊的化学式分别是 甲 ① .乙 ② .丙 ③ .丁 ④ .戊⑤ . ⑵乙的电子式是⑥ ⑶写出B元素的最高价氧化物与丁发生反应的化学方程式⑦ . ⑷在上述五种物质中是离子化合物的有:⑧ 35电解普通水(H2O)和重水(D2O)的混合物.通电一段时间后两极共生成气体18.5g.其体积为33.6L.求生成的气体中.重氢和普通氢的原子个数比是多少?
网址:http://m.1010jiajiao.com/timu3_id_151838[举报]
铁、铜单质及其化合物在生活、生产中有广泛应用.
(1)铁元素的原子结构示意图为 ;它在周期表中的位置是 .
(2)某炼铜反应为:Cu2S+2Cu2O→6Cu+SO2↑在上述反应中,氧化剂是 ;若反应中转移15mol电子,则氧化产物的质量为 .
(3)氧和硫属于同族元素,该族元素的原子最外层电子排布都可表示为 ;它们的原子最外层有 种不同能量的电子.
(4)氧和硫分别形成氢化物中比较稳定的是 (写电子式);该分子属于 (填“极性”或“非极性”)分子.
(5)与明矾相似,NH4Fe(SO4)2也可用作净水剂,其净水的原因是: .
(6)(NH4)2Fe(SO4)2?6H2O又称摩尔盐,它也可作净水剂,还用作化学试剂、医药、冶金、电镀等,请你设计实验检验摩尔盐中的阳离子: .
查看习题详情和答案>>
(1)铁元素的原子结构示意图为
(2)某炼铜反应为:Cu2S+2Cu2O→6Cu+SO2↑在上述反应中,氧化剂是
(3)氧和硫属于同族元素,该族元素的原子最外层电子排布都可表示为
(4)氧和硫分别形成氢化物中比较稳定的是
(5)与明矾相似,NH4Fe(SO4)2也可用作净水剂,其净水的原因是:
(6)(NH4)2Fe(SO4)2?6H2O又称摩尔盐,它也可作净水剂,还用作化学试剂、医药、冶金、电镀等,请你设计实验检验摩尔盐中的阳离子:
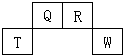 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等,请回答下列问题:(1)T元素的原子结构示意图为
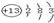
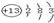
第二周期ⅣA族
第二周期ⅣA族
,R元素单质的电子式为

(2)原子序数比T少2的元素是
Na
Na
(填元素符号),用电子式表示该元素与W元素形成化合物的过程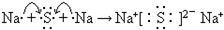
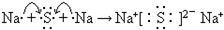
(3)原子序数比W多4的元素是
Ca
Ca
(填元素符号),该元素最高价氧化物的水化物溶液与W元素最高价氧化物的水化物溶液反应的离子方程式为:Ca2++2OH-+2H++SO42-=CaSO4↓+2H2O
Ca2++2OH-+2H++SO42-=CaSO4↓+2H2O
.A、B、C、D是原子序数依次增大的短周期元素,在周期表中A与B、B与C相邻.A与C、B与C组成的化合物都是机动车排出的大气污染物成分,C和D能形成原子个数比为1:1和1:2的两种离子化合物.
(1)B元素的原子结构示意图为 ;化合物D2C2的电子式为 .
(2)A、B、C、D四种元素所形成的单质晶体中,不可能形成分子晶体的元素是 (用元素符号表示).
(3)B的氢化物和B的最高价氧化物对应水化物反应生成Z,Z中的化学键类型属于 .
(4)AC2的空间构型是 ,属于 (填“极性分子”或“非极性分子”),AC2与D2C2反应的化学方程式是 .
(5)B和D组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 .
(6)已知8gA的 氢化物允分燃烧生成稳定的氧化物,放出445.15kJ热量,则A的氢化物燃烧热的热化学方程式为 .
查看习题详情和答案>>
(1)B元素的原子结构示意图为
(2)A、B、C、D四种元素所形成的单质晶体中,不可能形成分子晶体的元素是
(3)B的氢化物和B的最高价氧化物对应水化物反应生成Z,Z中的化学键类型属于
(4)AC2的空间构型是
(5)B和D组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是
(6)已知8gA的 氢化物允分燃烧生成稳定的氧化物,放出445.15kJ热量,则A的氢化物燃烧热的热化学方程式为
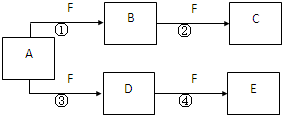 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
(1)Z元素的原子结构示意图为
(2)A的电子式为
(3)写出下列反应的化学方程式:①
(4)A和E反应生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为
(5)常温下,G的水溶液的PH=5,则由水电离的氢离子浓度为