题目内容
铁、铜单质及其化合物在生活、生产中有广泛应用.
(1)铁元素的原子结构示意图为 ;它在周期表中的位置是 .
(2)某炼铜反应为:Cu2S+2Cu2O→6Cu+SO2↑在上述反应中,氧化剂是 ;若反应中转移15mol电子,则氧化产物的质量为 .
(3)氧和硫属于同族元素,该族元素的原子最外层电子排布都可表示为 ;它们的原子最外层有 种不同能量的电子.
(4)氧和硫分别形成氢化物中比较稳定的是 (写电子式);该分子属于 (填“极性”或“非极性”)分子.
(5)与明矾相似,NH4Fe(SO4)2也可用作净水剂,其净水的原因是: .
(6)(NH4)2Fe(SO4)2?6H2O又称摩尔盐,它也可作净水剂,还用作化学试剂、医药、冶金、电镀等,请你设计实验检验摩尔盐中的阳离子: .
(1)铁元素的原子结构示意图为
(2)某炼铜反应为:Cu2S+2Cu2O→6Cu+SO2↑在上述反应中,氧化剂是
(3)氧和硫属于同族元素,该族元素的原子最外层电子排布都可表示为
(4)氧和硫分别形成氢化物中比较稳定的是
(5)与明矾相似,NH4Fe(SO4)2也可用作净水剂,其净水的原因是:
(6)(NH4)2Fe(SO4)2?6H2O又称摩尔盐,它也可作净水剂,还用作化学试剂、医药、冶金、电镀等,请你设计实验检验摩尔盐中的阳离子:
分析:(1)Fe的原子序数为26,有4个电子层,最外层电子数为2;
(2)Cu2S+2Cu2O→6Cu+SO2↑中,Cu元素的化合价由+1价降低为0,S元素的化合价由-2价升高为+4价;
(3)该族元素的原子最外层电子数均为6,有6种电子;
(4)非金属性O>S,则水稳定,为极性键形成的极性分子;
(5)铁离子水解生成胶体;
(6)检验铵根离子用碱和湿润的红色石蕊试纸,检验亚铁离子可利用KSCN和氯水.
(2)Cu2S+2Cu2O→6Cu+SO2↑中,Cu元素的化合价由+1价降低为0,S元素的化合价由-2价升高为+4价;
(3)该族元素的原子最外层电子数均为6,有6种电子;
(4)非金属性O>S,则水稳定,为极性键形成的极性分子;
(5)铁离子水解生成胶体;
(6)检验铵根离子用碱和湿润的红色石蕊试纸,检验亚铁离子可利用KSCN和氯水.
解答:解:(1)Fe的原子序数为26,有4个电子层,最外层电子数为2,其原子结构示意图为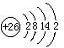 ,位于元素周期表中第四周期第ⅤⅢ族,故答案为:
,位于元素周期表中第四周期第ⅤⅢ族,故答案为: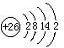 ;第四周期第ⅤⅢ族;
;第四周期第ⅤⅢ族;
(2)Cu2S+2Cu2O→6Cu+SO2↑中,Cu元素的化合价由+1价降低为0,S元素的化合价由-2价升高为+4价,氧化剂为Cu2S、Cu2O,该反应中转移6e-,SO2为氧化产物,反应中转移15mol电子,则氧化产物的质量为
mol×64g/mol=160g,故答案为:Cu2S、Cu2O;160g;
(3)该族元素的原子最外层电子数均为6,最外层电子排布都可表示为ns2np4,每个轨道上电子的自旋方向相反,则共有6种能量不同电子,故答案为:ns2np4;6;
(4)非金属性O>S,则水稳定,水的电子式为 ,结构不对称,为极性键形成的极性分子,
,结构不对称,为极性键形成的极性分子,
故答案为: ;极性;
;极性;
(5)铁离子水解生成胶体,具有吸附性,可净化水,故答案为:铁离子水解生成胶体,具有吸附性;
(6)检验铵根离子用碱和湿润的红色石蕊试纸,检验亚铁离子可利用KSCN和氯水,则实验方法为:取少量溶于水,加NaOH加热生成的气体可使湿润的红色石蕊试纸变蓝,则证明含铵根离子;另取少量溶于水,加KSCN溶液不变色,然后滴加氯水,溶液变为血红色,则证明含亚铁离子,
故答案为:取少量溶于水,加NaOH加热生成的气体可使湿润的红色石蕊试纸变蓝,则证明含铵根离子;另取少量溶于水,加KSCN溶液不变色,然后滴加氯水,溶液变为血红色,则证明含亚铁离子.
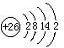 ,位于元素周期表中第四周期第ⅤⅢ族,故答案为:
,位于元素周期表中第四周期第ⅤⅢ族,故答案为: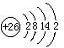 ;第四周期第ⅤⅢ族;
;第四周期第ⅤⅢ族;(2)Cu2S+2Cu2O→6Cu+SO2↑中,Cu元素的化合价由+1价降低为0,S元素的化合价由-2价升高为+4价,氧化剂为Cu2S、Cu2O,该反应中转移6e-,SO2为氧化产物,反应中转移15mol电子,则氧化产物的质量为
| 15 |
| 6 |
(3)该族元素的原子最外层电子数均为6,最外层电子排布都可表示为ns2np4,每个轨道上电子的自旋方向相反,则共有6种能量不同电子,故答案为:ns2np4;6;
(4)非金属性O>S,则水稳定,水的电子式为
 ,结构不对称,为极性键形成的极性分子,
,结构不对称,为极性键形成的极性分子,故答案为:
 ;极性;
;极性;(5)铁离子水解生成胶体,具有吸附性,可净化水,故答案为:铁离子水解生成胶体,具有吸附性;
(6)检验铵根离子用碱和湿润的红色石蕊试纸,检验亚铁离子可利用KSCN和氯水,则实验方法为:取少量溶于水,加NaOH加热生成的气体可使湿润的红色石蕊试纸变蓝,则证明含铵根离子;另取少量溶于水,加KSCN溶液不变色,然后滴加氯水,溶液变为血红色,则证明含亚铁离子,
故答案为:取少量溶于水,加NaOH加热生成的气体可使湿润的红色石蕊试纸变蓝,则证明含铵根离子;另取少量溶于水,加KSCN溶液不变色,然后滴加氯水,溶液变为血红色,则证明含亚铁离子.
点评:本题考查较综合,涉及铁的化学性质、盐类水解、离子检验、电子排布及氧化还原反应等,综合性较强,注重基础知识的考查,题目难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:
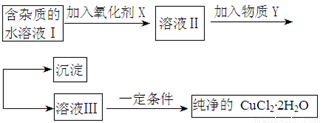
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
|
|
Fe3+ |
Fe2+ |
Cu2+ |
|
氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
|
氢氧化物沉淀完全时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
(1)加入氧化剂的目的是
(2)下列最适合作氧化剂X的是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是
(4)如果不用物质Y而直接用可溶性碱溶液能不能达到目的? (填“能”或者“不能”)。若不能,试解释原因 (若填“能”,此空不用回答)
(5)最后能不能直接蒸发得到CuCl2·2H2O? (填“能”或者“不能”)。若不能,应该如何操作才能得到CuCl2·2H2O (若填“能”,此空不用回答)
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 ,试解释原因
(8)FeCl3溶液具有净水作用的原因是