摘要:比较下列性质 ①Br与S 非金属性 ②Be与Mg 金属性 ③Mg(OH)2与Al(OH)3 碱性 ④H2S与HI 还原性 ⑤H3PO4与H2SO4 酸性
网址:http://m.1010jiajiao.com/timu3_id_151311[举报]
(1)下列曲线分别表示元素某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面的元素有关性质相符合的曲线的标号填入相应括号中.

①ⅡA族元素的最外层电子数
③O2-、F-、Na+、Mg2+、Al3+的离子半径
⑤第二周期元素Be、B、C、N、O的原子半径
(2)比较下列性质(用“>”、“=”、“<”填空)
①氧化性 Cl2
④稳定性 H2S
(3)元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化.
查看习题详情和答案>>

①ⅡA族元素的最外层电子数
a
a
②ⅦA族元素氢化物的沸点c
c
③O2-、F-、Na+、Mg2+、Al3+的离子半径
b
b
④第三周期元素的最高化合价e
e
⑤第二周期元素Be、B、C、N、O的原子半径
b
b
(2)比较下列性质(用“>”、“=”、“<”填空)
①氧化性 Cl2
>
>
Br2 ②酸性 H3PO4<
<
H2SO4 ③碱性 Mg(OH)2>
>
Al(OH)3④稳定性 H2S
<
<
H2O ⑤还原性H2S>
>
HCl(3)元素性质呈周期性变化的决定因素是
C
C
.A.元素原子半径大小呈周期性变化 B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化.
比较下列性质(用“>”、“<”填空)
①非金属性 Br
④稳定性 H2S
查看习题详情和答案>>
①非金属性 Br
>
>
I ②金属性 Be<
<
Mg ③碱性 Mg(OH)2>
>
Al(OH)3④稳定性 H2S
<
<
H2O ⑤酸性 H3PO4<
<
H2SO4.(12分) (1)下列曲线分别表示元素某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面的元素有关性质相符合的曲线的标号填入相应括号中。
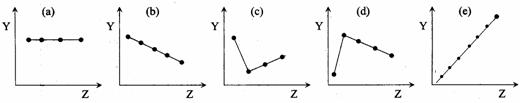 |
① ⅡA族元素的最外层电子数( ) ② ⅦA族元素氢化物的沸点( )
③ O2-、F-、Na+、Mg2+、Al3+的离子半径( ) ④第三周期元素的最高化合价( )
⑤ 第二周期元素Be、B、C、N、O的原子半径( )
(2) 比较下列性质(用“>”、“=”、“<”填空)
① 氧化性 Cl2 Br2 ② 酸性 H3PO4 H2SO4 ③ 碱性 Mg(OH)2 Al(OH)3
④ 稳定性 H2S H2O ⑤ 还原性H2S HCl
(3) 元素性质呈周期性变化的决定因素是 。
A.元素原子半径大小呈周期性变化 B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
查看习题详情和答案>>