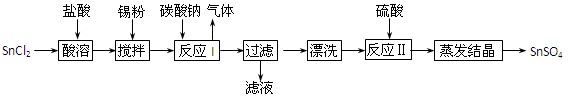
题目内容
(12分) (1)下列曲线分别表示元素某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面的元素有关性质相符合的曲线的标号填入相应括号中。
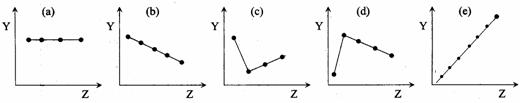 |
① ⅡA族元素的最外层电子数( ) ② ⅦA族元素氢化物的沸点( )
③ O2-、F-、Na+、Mg2+、Al3+的离子半径( ) ④第三周期元素的最高化合价( )
⑤ 第二周期元素Be、B、C、N、O的原子半径( )
(2) 比较下列性质(用“>”、“=”、“<”填空)
① 氧化性 Cl2 Br2 ② 酸性 H3PO4 H2SO4 ③ 碱性 Mg(OH)2 Al(OH)3
④ 稳定性 H2S H2O ⑤ 还原性H2S HCl
(3) 元素性质呈周期性变化的决定因素是 。
A.元素原子半径大小呈周期性变化 B.元素的相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
(共12分)
(1) ① a; ② c; ③ b; ④ e;⑤ b。(各1分,共5分)
(2) ①>;②<; ③>; ④<;⑤>。(各1分,共5分)
(3)C(2分)

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
 ,它的含氧官能团名称为 、 。
,它的含氧官能团名称为 、 。  xC(g)。请填写下列空白:
xC(g)。请填写下列空白: