摘要:A.B.C.D.E五种物质的转化关系如下图 ⑴已知A为二元碱.其金属阳离子核外有18个电子.写出各物质的化学式:A .C .E . (2)写出下列两个变化的离子方程式 B→D . A→B . 37用下图组装实验可以研究CO的还原性: 填写下列空白: (1)从A的长颈漏斗应加入的试剂是 A.稀硫酸 B.浓硫酸 C.稀盐酸 D.浓硝酸 (2)装置B中最适宜的试剂是 . (3)装置D中发生反应的化学方程式是 . (4)装置E中发生的现象是 (5)必须用装置C吸收除去气体中水蒸气的理由主要是 . (6)若根据F中石灰水变浑浊的现象也能确认CO具有还原性.应在图中装置 与 之间连接下图的哪一种装置 .
网址:http://m.1010jiajiao.com/timu3_id_149183[举报]
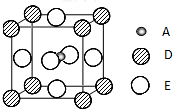 (2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.
(2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.请回答下列问题:
(1)A、B、C、D四种元素中,电负性最大的是
O
O
(填元素符号).(2)B的氢化物的沸点远高于A的氢化物的主要原因是
NH3分子间能形成氢键
NH3分子间能形成氢键
.(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为
sp
sp
.(4)E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有
孤对电子
孤对电子
.(5)最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性.A原子的配位数为
6
6
;该晶体的化学式为MgNi3C
MgNi3C
. (2011?濮阳二模)A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表
(2011?濮阳二模)A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表| 元素 | 相关信息 |
| A | A的第一电离能低于同周期相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其单质分子中只有一条共价键 |
| E | E在所处周期中电负性最大,且与D是同一主族元素 |
B
B
BC
C
CO
O
DCl
Cl
,EBr
Br
;(2)A与D形成的化合物的化学式为
BCl3
BCl3
,其分子的立体构型是平面正三角形
平面正三角形
,是非极性
非极性
(填“极性”或“非极性”)分子;(3)请比较化合物ED与Cl2、Br2、I2三者沸点由高到低的顺序:
I2
I2
>Br2
Br2
>BrCl
BrCl
>Cl2
Cl2
,其理由是
BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高
BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高
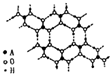
.(4)A的最高价氧化物的水化物(H2AO3)晶体是一种白色片层状结构,层内的H3AO3分子这间有序排列如图.
①在H3AO3分子中,A原子的杂化方式是
sp2
sp2
;②在晶体中,H3AO3分子能形成这种排列方式的原因是
H3BO3分子之间氢原子与氧原子之间存在氢键
H3BO3分子之间氢原子与氧原子之间存在氢键
;③在H3AO3晶体中层与层之间的作用力是
分子间作用力
分子间作用力
,该晶体属于分子
分子
晶体.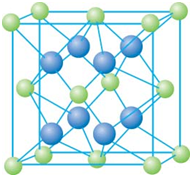 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:
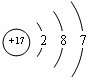
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:(1)A元素的名称是
氢
氢
;(2)B元素的轨道表示式是
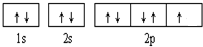


氟化氢分子间存在氢键,氯化氢分子间没有氢键
氟化氢分子间存在氢键,氯化氢分子间没有氢键
;(3)E属于元素周期表中第
四
四
周期,第VIIB
VIIB
族的元素,其元素名称是锰
锰
;属于元素周期表中的d
d
区(填元素分区),它的+2价离子的电子排布式为1s22s22p63s23p63d5
1s22s22p63s23p63d5
;(4)从图中可以看出,D跟B形成的离子化合物的化学式为
CaF2
CaF2
;该离子化合物晶体的密度为a g?cm-3,则晶胞的体积是| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
已知A、B、C、D、E、F均为周期表中前36号元素,且原子序数依次增大.A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A、F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道.D和E原子的第一至第四电离能如下表所示:
(1)A、B、C三种元素的电负性最大的是
(2)F基态原子的核外电子排布式是
(3)根据等电子原理,写出AB+的电子式:
 .
.
(4)已知:F3+可形成配位数为6的配合物.组成为FCl3?6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为
A.[CrCl(H2O)5]Cl2?H2O B.[CrCl2(H2O)4]Cl?2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3]?3H2O.
查看习题详情和答案>>
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |
F
F
(填写元素符号),D、E两元素中D的第一电离能较大的原因是原子外围电子排布为3s2,s轨道全充满,相对稳定
原子外围电子排布为3s2,s轨道全充满,相对稳定
.(2)F基态原子的核外电子排布式是
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于吸收
吸收
光谱(填“吸收”或“发射”).(3)根据等电子原理,写出AB+的电子式:


(4)已知:F3+可形成配位数为6的配合物.组成为FCl3?6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为
[CrCl2(H2O)4]Cl?2H2O
[CrCl2(H2O)4]Cl?2H2O
.A.[CrCl(H2O)5]Cl2?H2O B.[CrCl2(H2O)4]Cl?2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3]?3H2O.
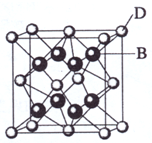 (2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.
(2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.请回答:
(1)A元素的名称是
氢
氢
;(2)B的元素符号是
F
F
,C的元素符号是Cl
Cl
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是氟化氢分子间存在氢键,氯化氢分子间没有氢键
氟化氢分子间存在氢键,氯化氢分子间没有氢键
(3)E属元素周期表中第
四
四
周期,第VIIB
VIIB
族的元素,其元素名称是锰
锰
,它的+2价离子的电子排布式为1s22s22p63s23p63d5
1s22s22p63s23p63d5
:(4)从图中可以看出,D跟B形成的离子化合物的化学式为
CaF2
CaF2
;该离子化合物晶体的密度为a g?cm-3,则晶胞的体积是| 4×78g/mol |
| ag?cm-3×6.02×1023/mol |
| 4×78g/mol |
| ag?cm-3×6.02×1023/mol |