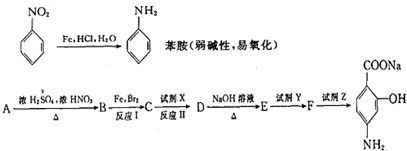
题目内容
 (2011?濮阳二模)A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表
(2011?濮阳二模)A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大,其相关信息如下表| 元素 | 相关信息 |
| A | A的第一电离能低于同周期相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其单质分子中只有一条共价键 |
| E | E在所处周期中电负性最大,且与D是同一主族元素 |
B
B
BC
C
CO
O
DCl
Cl
,EBr
Br
;(2)A与D形成的化合物的化学式为
BCl3
BCl3
,其分子的立体构型是平面正三角形
平面正三角形
,是非极性
非极性
(填“极性”或“非极性”)分子;(3)请比较化合物ED与Cl2、Br2、I2三者沸点由高到低的顺序:
I2
I2
>Br2
Br2
>BrCl
BrCl
>Cl2
Cl2
,其理由是
BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高
BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高
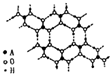
.(4)A的最高价氧化物的水化物(H2AO3)晶体是一种白色片层状结构,层内的H3AO3分子这间有序排列如图.
①在H3AO3分子中,A原子的杂化方式是
sp2
sp2
;②在晶体中,H3AO3分子能形成这种排列方式的原因是
H3BO3分子之间氢原子与氧原子之间存在氢键
H3BO3分子之间氢原子与氧原子之间存在氢键
;③在H3AO3晶体中层与层之间的作用力是
分子间作用力
分子间作用力
,该晶体属于分子
分子
晶体.分析:A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大.C原子p轨道和s轨道中的电子数相等,则C原子有2个电子层或3个电子层,所以C核外电子排布为1s22s22p4或1s22s22p63s2,故C为氧元素或镁元素,C与非金属的原子结合时形成共价键,则C为非金属元素,故C为氧元素;E在所处周期中电负性最大,则E为ⅦA族,且与D是同一主族元素,原子序数E>D,D与A、B、C均不同周期,则D为氯元素,E为溴元素;A的第一电离能低于同周期相邻元素,A处于ⅢA族或ⅥA族,故A为硼元素;原子序数B介于硼元素与氧元素之间,B原子中成对电子数等于未成对电子数的2倍,则B处于第二周期,核外电子排布为1s22s22p2,故B为碳元素.
解答:解:A、B、C、D、E五种元素都是36号以前元素,原子序数依次增大.C原子p轨道和s轨道中的电子数相等,则C原子有2个电子层或3个电子层,所以C核外电子排布为1s22s22p4或1s22s22p63s2,故C为氧元素或镁元素,C与非金属的原子结合时形成共价键,则C为非金属元素,故C为氧元素;E在所处周期中电负性最大,则E为ⅦA族,且与D是同一主族元素,原子序数E>D,D与A、B、C均不同周期,则D为氯元素,E为溴元素;A的第一电离能低于同周期相邻元素,A处于ⅢA族或ⅥA族,故A为硼元素;原子序数B介于硼元素与氧元素之间,B原子中成对电子数等于未成对电子数的2倍,则B处于第二周期,核外电子排布为1s22s22p2,故B为碳元素.
故A为硼元素,B为碳元素;C为氧元素;D为氯元素,E为溴元素.
(1)由上述分析可知,A为B;B为C;C为O;D为Cl;E为Br,故答案为:B;C;O;Cl;Br;
(2)A为硼元素,D为氯元素;A与D形成的化合物中硼为+3价,氯为-1价,化学式为 BCl3,分子中形成3对共用电子对,硼原子最外层电子全部参与成键,硼原子采取sp2杂化,其分子的立体构型是平面正三角形,分子为对称结构是 非极性分子,故答案为:BCl3;平面正三角形;非极性;
(3)D为氯元素,E为溴元素,化合物ED为BrCl,BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高,沸点由高到低的顺序:I2>Br2>BrCl>Cl2,
故答案为:I2>Br2>BrCl>Cl2;BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高;
(4)A为硼元素,A的最高价氧化物的水化物(H2BO3)晶体是一种白色片层状结构,层内的H3BO3分子这间有序排列如图.
①由结构图可知,在H3BO3分子中硼原子与氧原子之间形成单键,分子中形成3对共用电子对,硼原子最外层电子全部参与成键,硼原子采取sp2杂化,故答案为:sp2;
②由结构图可知,在晶体中H3BO3分子之间氢原子与氧原子之间存在氢键,氢键的存在使H3BO3分子形成层内正六边形结构,
故答案为:H3BO3分子之间氢原子与氧原子之间存在氢键;
③由结构图可知,晶体中存在H3BO3分子,H3BO3晶体为分子晶体,在H3BO3晶体中层与层之间的作用力是分子间作用力,
故答案为:分子间作用力;分子.
故A为硼元素,B为碳元素;C为氧元素;D为氯元素,E为溴元素.
(1)由上述分析可知,A为B;B为C;C为O;D为Cl;E为Br,故答案为:B;C;O;Cl;Br;
(2)A为硼元素,D为氯元素;A与D形成的化合物中硼为+3价,氯为-1价,化学式为 BCl3,分子中形成3对共用电子对,硼原子最外层电子全部参与成键,硼原子采取sp2杂化,其分子的立体构型是平面正三角形,分子为对称结构是 非极性分子,故答案为:BCl3;平面正三角形;非极性;
(3)D为氯元素,E为溴元素,化合物ED为BrCl,BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高,沸点由高到低的顺序:I2>Br2>BrCl>Cl2,
故答案为:I2>Br2>BrCl>Cl2;BrCl与Cl2、Br2、I2结构相似,都能形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高;
(4)A为硼元素,A的最高价氧化物的水化物(H2BO3)晶体是一种白色片层状结构,层内的H3BO3分子这间有序排列如图.
①由结构图可知,在H3BO3分子中硼原子与氧原子之间形成单键,分子中形成3对共用电子对,硼原子最外层电子全部参与成键,硼原子采取sp2杂化,故答案为:sp2;
②由结构图可知,在晶体中H3BO3分子之间氢原子与氧原子之间存在氢键,氢键的存在使H3BO3分子形成层内正六边形结构,
故答案为:H3BO3分子之间氢原子与氧原子之间存在氢键;
③由结构图可知,晶体中存在H3BO3分子,H3BO3晶体为分子晶体,在H3BO3晶体中层与层之间的作用力是分子间作用力,
故答案为:分子间作用力;分子.
点评:本题考查原子结构与位置关系、核外电子排布规律、晶体结构、杂化轨道等,难度较大,推断元素是解题关键,突破口为C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键.

练习册系列答案
相关题目
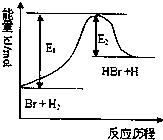 (2011?濮阳二模)参照反应Br+H2?HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
(2011?濮阳二模)参照反应Br+H2?HBr+H的能量对反应历程的示意图,下列叙述中正确的是( ) ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )