摘要:20.16.8gNaHCO3和7.8克Na2O2在密闭容器中灼烧.充分反应后.将密闭容器保持温度为500℃.最后容器内物质是( ) A.Na2CO3.Na2O.O2 B.Na2CO3.O2.H2O(g) C.Na2CO3.CO2.O2.H2O(g) D.NaHCO3.Na2CO3.O2
网址:http://m.1010jiajiao.com/timu3_id_147967[举报]
NaHCO3受热分解产生Na2CO3、CO2和H2O
(1)写出该反应的化学方程式.
(2)当16.8gNaHCO3加热至质量不再变化时,试求生成Na2CO3的质量和所产生CO2在标准状况下的体积. .
查看习题详情和答案>>
(1)写出该反应的化学方程式.
(2)当16.8gNaHCO3加热至质量不再变化时,试求生成Na2CO3的质量和所产生CO2在标准状况下的体积.
加热16.8gNaHCO3至没有气体放出时,剩余的物质是什么?计算剩余物质的质量和物质的量。
(1)加热NaHCO3时发生的化学反应:___________________________
(2)剩余的物质是 ,质量为 ,物质的量为 。(写出计算过程)
加热16.8gNaHCO3至没有气体放出时,剩余的物质是什么?计算剩余物质的质量和物质的量。
(1)加热NaHCO3时发生的化学反应:___________________________
(2)剩余的物质是 ,质量为 ,物质的量为 。(写出计算过程)
查看习题详情和答案>>
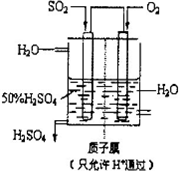 (2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(2010?聊城模拟)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:SO2+
| 1 |
| 2 |
(1)在T1温度时,该反应的平衡常数K=
| 10 |
| 3 |
>
>
逆反应速率(填“<”、“>”或“=”).(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为
50%
50%
.(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是
AC
AC
(填字母).A.保持温度和容器体积不变,充入1.0molO2
B.保持温度和容器内压强不变,充入2.0molSO2和5.0molO2
C.降低温度
D.在其他条件不变时,减小容器的容积
(4)有人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
SO2+2H2O=SO42-+4H++2e-
SO2+2H2O=SO42-+4H++2e-
.(5)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,
c(C
| ||
c(S
|
40
40
.[已知该温度时,KSP(BaSO4)=1.3×10-10,KSP(BaCO3)=5.2×10-9].下列说法正确的是( )
| A、16 O2和18O2互为同位素 | B、光照条件下新戊烷与Br2反应,其一溴代物只有一种 | C、C4H10 有三种同分异构体 | D、淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 |