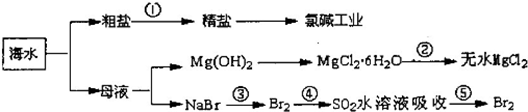
��Ŀ����
 ��2010?�ij�ģ�⣩���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮
��2010?�ij�ģ�⣩���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮��֪��SO2+
| 1 |
| 2 |
��1����T1�¶�ʱ���÷�Ӧ��ƽ�ⳣ��K=
| 10 |
| 3 |
��
��
�淴Ӧ���ʣ����������������=��������2����T2�¶�ʱ����ʼ��100L���ܱ������м���4.0molSO2��10.0molO2��һ�������µ���Ӧ�ﵽƽ��ʱ���ų�����196kJ����ʱ���������ת����Ϊ
50%
50%
����3���ڣ�2���еķ�Ӧ�ﵽƽ��ı�������������ʹSO2ƽ��Ũ�ȱ�ԭ����С����
AC
AC
������ĸ����A�������¶Ⱥ�����������䣬����1.0molO2
B�������¶Ⱥ�������ѹǿ���䣬����2.0molSO2��5.0molO2
C�������¶�
D����������������ʱ����С�������ݻ�
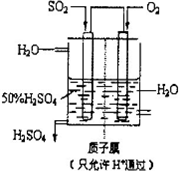
��4��������������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ��
SO2+2H2O=SO42-+4H++2e-
SO2+2H2O=SO42-+4H++2e-
����5����������Ƶ������Σ���һ���¶��£���K2SO4��Һ�еμ�Na2CO3��Һ��BaCl2��Һ�������ֳ�������ʱ��
c(C
| ||
c(S
|
40
40
��[��֪���¶�ʱ��KSP(BaSO4)=1.3��10-10��KSP(BaCO3)=5.2��10-9]����������1������Ũ������ƽ�ⳣ���Ĵ�С�жϷ�Ӧ���еķ���
��2���ȸ���ƽ�ⳣ�������c��SO2�����ٸ���ת���ʹ�ʽ���SO2��ת���ʣ�
��3������Ũ�ȡ��¶ȡ�ѹǿ����������Ի�ѧƽ���Ӱ�죬���ƽ���ƶ���c��SO2����
��4������ԭ��ط�Ӧ��������ԭ��Ӧ������ʧ���ӷ���������Ӧ�������ϵõ����ӷ�����ԭ��Ӧ��
��5�����ݳ���ת���ķ�Ӧ��������ܶȻ��������������
��2���ȸ���ƽ�ⳣ�������c��SO2�����ٸ���ת���ʹ�ʽ���SO2��ת���ʣ�
��3������Ũ�ȡ��¶ȡ�ѹǿ����������Ի�ѧƽ���Ӱ�죬���ƽ���ƶ���c��SO2����
��4������ԭ��ط�Ӧ��������ԭ��Ӧ������ʧ���ӷ���������Ӧ�������ϵõ����ӷ�����ԭ��Ӧ��
��5�����ݳ���ת���ķ�Ӧ��������ܶȻ��������������
����⣺��1��SO2+
O2?SO3��H=-98KJ?mol-1����100L�ĺ����ܱ������У�����3.0molSO2��16.0molO2��3.0molSO3��
��ΪŨ����QC=
=
=2.5��K�����Ի�ѧ��Ӧ������У���v��������v���棩���ʴ�Ϊ������
��2����T2�¶�ʱ����ʼ��100L���ܱ������м���4.0molSO2��10.0molO2��һ�������µ���Ӧ�ﵽƽ��ʱ���ų�����196kJ����1molSO2��ȫ��Ӧ����98KJ����һ�������µ���Ӧ�ﵽƽ��ʱ���ų�����196kJ�����Ķ����������ʵ���=
=2mol�����ݻ�ѧƽ������ʽ��ʽ���㣺
SO2��g��+
O2��g��?SO3��g��
��ʼ����mol�� 4 10 0
�仯����mol�� 2 1 2
ƽ������mol�� 2 9 2
����SO2��ת���ʦ�=
��100%=50%���ʴ�Ϊ��50%��
��3��A�������¶Ⱥ�����������䣬O2��Ũ������ƽ�������ƶ���SO2��Ũ�ȼ�С������A��ȷ��
B�������¶Ⱥ�������ѹǿ���䣬����2.0molSO2��5.0molO2���µ�ƽ����ԭƽ���Ч��SO2��Ũ�Ȳ��䣬����B����
C�������¶ȣ�ƽ������ȵķ����ƶ���������ӦΪ���ȣ�����ƽ�������ƶ���SO2��Ũ�ȼ�С������C��ȷ��
D����������������ʱ����С�������ݻ���SO2��Ũ��˲������֮��ƽ��������������ٵķ����ƶ�����������Ӧ�����ƶ���SO2��Ũ�ȼ�С���ٴε���ƽ��ʱSO2��Ũ���Ա�ԭ��������D����
�ʴ�Ϊ��A��C��
��4������ͼװ�÷�������������ʧ���ӷ���������Ӧ��������������Ϊ������������ˮ��������缫��ӦΪ��SO2+2H2O=SO42-+4H++2e-��
�ʴ�Ϊ��SO2+2H2O=SO42-+4H++2e-��
��5����һ���¶��£���K2SO4��Һ�еμ�Na2CO3��Һ��BaCl2��Һ�������ֳ�������ʱ�������ܶȻ�������֪���������ᱵ��������ת����BaCO3+SO42-=BaSO4+CO32-�����̼�ᱵ�����ᱵ�ܶȻ�������
=
=
=40��
�ʴ�Ϊ��40��
| 1 |
| 2 |
��ΪŨ����QC=
| c(SO3) | ||
c(SO2)[c(O2)]
|
| ||||||
|
��2����T2�¶�ʱ����ʼ��100L���ܱ������м���4.0molSO2��10.0molO2��һ�������µ���Ӧ�ﵽƽ��ʱ���ų�����196kJ����1molSO2��ȫ��Ӧ����98KJ����һ�������µ���Ӧ�ﵽƽ��ʱ���ų�����196kJ�����Ķ����������ʵ���=
| 1mol��196KJ |
| 98KJ |
SO2��g��+
| 1 |
| 2 |
��ʼ����mol�� 4 10 0
�仯����mol�� 2 1 2
ƽ������mol�� 2 9 2
����SO2��ת���ʦ�=
| 2mol |
| 4mol |
��3��A�������¶Ⱥ�����������䣬O2��Ũ������ƽ�������ƶ���SO2��Ũ�ȼ�С������A��ȷ��
B�������¶Ⱥ�������ѹǿ���䣬����2.0molSO2��5.0molO2���µ�ƽ����ԭƽ���Ч��SO2��Ũ�Ȳ��䣬����B����
C�������¶ȣ�ƽ������ȵķ����ƶ���������ӦΪ���ȣ�����ƽ�������ƶ���SO2��Ũ�ȼ�С������C��ȷ��
D����������������ʱ����С�������ݻ���SO2��Ũ��˲������֮��ƽ��������������ٵķ����ƶ�����������Ӧ�����ƶ���SO2��Ũ�ȼ�С���ٴε���ƽ��ʱSO2��Ũ���Ա�ԭ��������D����
�ʴ�Ϊ��A��C��
��4������ͼװ�÷�������������ʧ���ӷ���������Ӧ��������������Ϊ������������ˮ��������缫��ӦΪ��SO2+2H2O=SO42-+4H++2e-��
�ʴ�Ϊ��SO2+2H2O=SO42-+4H++2e-��
��5����һ���¶��£���K2SO4��Һ�еμ�Na2CO3��Һ��BaCl2��Һ�������ֳ�������ʱ�������ܶȻ�������֪���������ᱵ��������ת����BaCO3+SO42-=BaSO4+CO32-�����̼�ᱵ�����ᱵ�ܶȻ�������
| c(CO22-) |
| c(SO42-) |
| Ksp(BaCO3) |
| Ksp(BaSO4) |
| 5.2��10-9 |
| 1.3��10-10 |
�ʴ�Ϊ��40��
���������⿼���˻�ѧƽ����й�֪ʶ��������Ũ�����жϻ�ѧ��Ӧ���еķ���ת���ʵļ��㡢��������Ի�ѧƽ���Ӱ���Լ��йػ�ѧ���㣬����ת���ļ���Ӧ�ã���������ۺ���ǿ��

��ϰ��ϵ�д�
 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д�
�����Ŀ