题目内容
NaHCO3受热分解产生Na2CO3、CO2和H2O(1)写出该反应的化学方程式.
(2)当16.8gNaHCO3加热至质量不再变化时,试求生成Na2CO3的质量和所产生CO2在标准状况下的体积.
分析:NaHCO3不稳定,加热易分解,发生2NaHCO3
Na2CO3+CO2↑+H2O,n(NaHCO3)=
=0.2mol,结合反应的方程式计算该题.
| ||
| 16.8g |
| 84g/mol |
解答:解:(1)NaHCO3不稳定,加热易分解,发生2NaHCO3
Na2CO3+CO2↑+H2O,故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;
(2)n(NaHCO3)=
=0.2mol,
2NaHCO3
Na2CO3+CO2↑+H2O,
2mol 106g 22.4L
0.2mol m(Na2CO3) V(CO2)
m(Na2CO3)=
=10.6g,
V(CO2)=
=2.24L,
故答案为:m(Na2CO3)=10.6g、V(CO2)=2.24L.
| ||
| ||
(2)n(NaHCO3)=
| 16.8g |
| 84g/mol |
2NaHCO3
| ||
2mol 106g 22.4L
0.2mol m(Na2CO3) V(CO2)
m(Na2CO3)=
| 0.2mol×106g |
| 2mol |
V(CO2)=
| 0.2mol×22.4L |
| 2mol |
故答案为:m(Na2CO3)=10.6g、V(CO2)=2.24L.
点评:本题考查钠的重要化合物,为高频考点,侧重于学生的分析能力、计算能力和元素化合物知识的综合理解和运用的考查,有利于培养学生的良好的科学素养,提高学生的学习积极性,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10℃时,在烧杯中加入0.1mol/L的NaHCO3溶液400mL,加热,测得该溶液的PH发生如下变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为: ;
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH 8.3(填“>”、“<”或“=”),说明乙正确;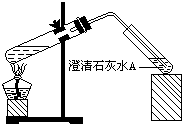
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明 (填“甲”或“乙”)推断正确;
(5)将一定体积0.1mol/L的NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为10.4;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为9.5.据此资料可以判断 (填“甲”或“乙”)推测正确,原因是 .
| 温度(℃) | 10 | 20 | 30 | 40 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH

(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明
(5)将一定体积0.1mol/L的NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为10.4;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为9.5.据此资料可以判断
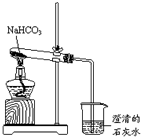 实验室利用如图所示装置进行NaHCO3的受热分解实验.请回答:
实验室利用如图所示装置进行NaHCO3的受热分解实验.请回答: