摘要:原创在一定温度下.反应H2(g)+X2(g) HX(g)的平衡常数为10. 则反应2HX(g) H2(g)+X2 A 0.01 B 1 C 10 D 100
网址:http://m.1010jiajiao.com/timu3_id_145398[举报]
(2013?烟台模拟)硫、氮、碘都是重要的非金属元素.
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应中还原剂是
(2)已知:2I(g)═I2(g)△H=-151 kJ?mol-1;2H(g)═H2(g)△H=-436 kJ?mol-1;HI(g)=H(g)+I(g)△H=+298 kJ?mol-1.相同条件下,H2与I2反应生成HI的热化学方程式为:H2(g)+I2(g)=2HI(g)△H=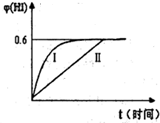
(3)将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?2HI(g)并达平衡.HI的体积分数φ(HI)随时间变化如图曲线II所示:
①达到平衡时,I2(g)的物质的量浓度为
②保持加入的反应物的物质的量不变,若改变反应条
件,在某一条件下φ(HI)的变化如曲线I所示,则该条件可能是
A.恒温条件下,缩小反应的容积 B.恒容条件下.加入适当催化剂
C.在恒容下,升高温度 D.在恒容下,充入N2使容器压强增大
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol Hl(g),发生反应达到平衡时,H2的体积分数为
查看习题详情和答案>>
(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O.该反应中还原剂是
H2S
H2S
.若反应过程中转移了0.3mol电子,则反应的HNO3的质量是6.3
6.3
g.(2)已知:2I(g)═I2(g)△H=-151 kJ?mol-1;2H(g)═H2(g)△H=-436 kJ?mol-1;HI(g)=H(g)+I(g)△H=+298 kJ?mol-1.相同条件下,H2与I2反应生成HI的热化学方程式为:H2(g)+I2(g)=2HI(g)△H=
-9
-9
kJ?mol-1.
(3)将1molI2(g)和2molH2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?2HI(g)并达平衡.HI的体积分数φ(HI)随时间变化如图曲线II所示:
①达到平衡时,I2(g)的物质的量浓度为
0.05
0.05
mol?L-1.②保持加入的反应物的物质的量不变,若改变反应条
件,在某一条件下φ(HI)的变化如曲线I所示,则该条件可能是
AB
AB
(填编号),在这种条件下平衡常数K值不变
不变
(填“增大”、“变小”或“不变’,).A.恒温条件下,缩小反应的容积 B.恒容条件下.加入适当催化剂
C.在恒容下,升高温度 D.在恒容下,充入N2使容器压强增大
③若保持温度不变,在另一相同的2L密闭容器中加入1mol H2(g)和2mol Hl(g),发生反应达到平衡时,H2的体积分数为
37%
37%
.下列有关说法正确的是( )
| A、金属制品电镀时,以待镀制品为阳极,镀层金属为阴极 | B、某反应的△H<0、△S<0,则该反应在低温下一定不能自发进行 | C、在一定温度下,反应CaCO3(s)=CaO(s)+CO2(g)的△H>0、△S<0 | D、常温下,0.1 mol?L-1醋酸溶液加水稀释时,醋酸电离平衡正向移动,溶液的pH增大 |
将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+2B(g)?C(g)+D(g)△H<0,C的体积分数随时间变化如图l中曲线a所示 下列说法正确的是( )
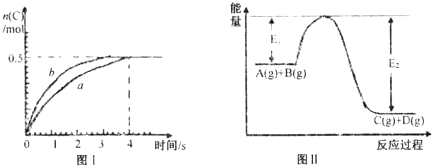

| A、此反应过程中的能量变化可用上图II表示 | B、此温度下,该反应的平衡常数的值为1 | C、该反应4s内平均速率v(A)=0.125mol?L-1?s-1 | D、若在恒温加大反应容器的容积条件下,该反应将按b曲线进行 |
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g)
Si3N4(s)+6CO(g)△H<0
(1)该反应的平衡常数表达式为K=
(2)上述反应的熵变△S
(3)在一定温度下上述反应达到平衡的标志是
A.单位时间生成2摩尔Si3N4的同时生成1摩尔的N2
B.容器内c(N2):c(CO)=1:3
C.容器内的气体中,CO的百分含量保持不变
D.单位时间消耗1摩尔SiO2的同时生成2摩尔的C
(4)达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图:

若不改变N2、CO的量,则图中t4时引起平衡移动的条件可能是
查看习题详情和答案>>
3SiO2(s)+6C(s)+2N2(g)
| 高温 |
(1)该反应的平衡常数表达式为K=
=
| c6(CO) |
| c2(N2) |
=
;升高温度,其平衡常数值| c6(CO) |
| c2(N2) |
减小
减小
(选填“增大”、“减小”或“不变”).(2)上述反应的熵变△S
>
>
0(选填“>、<或=”).(3)在一定温度下上述反应达到平衡的标志是
CD
CD
(填序号)A.单位时间生成2摩尔Si3N4的同时生成1摩尔的N2
B.容器内c(N2):c(CO)=1:3
C.容器内的气体中,CO的百分含量保持不变
D.单位时间消耗1摩尔SiO2的同时生成2摩尔的C
(4)达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图:

若不改变N2、CO的量,则图中t4时引起平衡移动的条件可能是
升高温度后压缩体积增大压强
升高温度后压缩体积增大压强
(写一种);图中t6时引起变化的条件是加入催化剂
加入催化剂
;图中表示平衡混合气体中CO的含量最高的一段时间是t3~t4
t3~t4
. 将1mol I2(g)和2mol H2置于5L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数w(HI)随时间变化如曲线(Ⅱ)所示:
将1mol I2(g)和2mol H2置于5L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g)△H<0,并达到平衡.HI的体积分数w(HI)随时间变化如曲线(Ⅱ)所示:(1)达到平衡时,I2(g)的物质的量浓度为
0.02mol/L
0.02mol/L
.(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ)所示,在乙条件下w(HI)的变化如曲线(Ⅲ)所示.则甲条件可能是
③⑤
③⑤
,乙条件可能是④
④
(填入下列条件的序号).①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂.