题目内容
下列有关说法正确的是( )
| A、金属制品电镀时,以待镀制品为阳极,镀层金属为阴极 | B、某反应的△H<0、△S<0,则该反应在低温下一定不能自发进行 | C、在一定温度下,反应CaCO3(s)=CaO(s)+CO2(g)的△H>0、△S<0 | D、常温下,0.1 mol?L-1醋酸溶液加水稀释时,醋酸电离平衡正向移动,溶液的pH增大 |
分析:A.电镀时,镀层作阳极,镀件作阴极;
B.根据△G=△H-T△S<0判断反应的自发性;
C.分解反应为吸热反应,反应前后气体体积增大的反应熵变增大;
D.加水稀释醋酸促进醋酸电离,但溶液中氢离子浓度减小.
B.根据△G=△H-T△S<0判断反应的自发性;
C.分解反应为吸热反应,反应前后气体体积增大的反应熵变增大;
D.加水稀释醋酸促进醋酸电离,但溶液中氢离子浓度减小.
解答:解:A.电镀时,镀层作阳极,镀件作阴极,所以镀层连接电源正极,待镀制品连接电源负极,故A错误;
B.某反应的△H<0、△S<0,如果△G=△H-T△S<0则该反应能自发进行,故B错误;
C.分解反应为吸热反应,反应前后气体体积增大的反应熵变增大,所以该反应的△H>0、△S>0,故C错误;
D.加水稀释醋酸促进醋酸电离,但溶液中氢离子增大程度小于溶液体积增大程度,所以氢离子浓度减小,溶液的pH增大,故D正确;
故选D.
B.某反应的△H<0、△S<0,如果△G=△H-T△S<0则该反应能自发进行,故B错误;
C.分解反应为吸热反应,反应前后气体体积增大的反应熵变增大,所以该反应的△H>0、△S>0,故C错误;
D.加水稀释醋酸促进醋酸电离,但溶液中氢离子增大程度小于溶液体积增大程度,所以氢离子浓度减小,溶液的pH增大,故D正确;
故选D.
点评:本题涉及电解原理、反应自发性的判断、弱电解质的电离等,根据弱电解质电离特点、电镀原理等知识点来分析解答,易错选项是D,注意:加水稀释促进醋酸电离,溶液中氢离子浓度减小,氢氧根离子浓度增大,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )
(2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )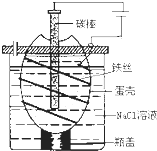 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,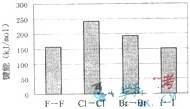 (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.