网址:http://m.1010jiajiao.com/timu3_id_145130[举报]
①NH3+H2O+CO2=NH4HCO3;②NH4HCO3+NaCl=NaHCO3↓+NH4Cl;③2NaHCO3
| ||
(1)“侯氏制碱法”生产过程中涉及到的基本反应类型是
A.置换反应;B.化合反应;C.分解反应;D.复分解反应
(2)第②步中加入的是磨细的食盐粉,食盐磨细的目的是
若第②步中得到的NaHCO3中含有少量的NH4HCO3,但不会影响产品Na2CO3的纯度,原因是
(3)若纯碱中含有NaHCO3杂质,为测定试样中纯碱的质量分数,用右图中的装置进行实验.主要实验步骤如下:
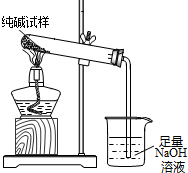
用天平准确称量出干燥试管的质量为20.2克,然后称取4.0克已研碎的纯碱样品并放入干燥的试管中.用酒精灯加热,待充分反应并冷却后,在天平上称出试管和碳酸钠的质量23.5克.
①停止加热前,要进行的操作是
②该试样中纯碱的质量分数为
[查阅资料]
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为
(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示.
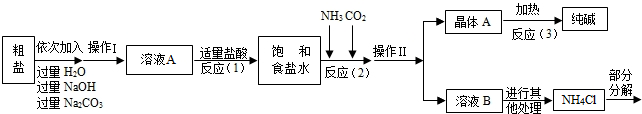
上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(晶体)↓+NH4Cl;分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为
【问题讨论】
(1)溶液A中的溶质为
(2)上述生产流程中可循环使用的是
A.CO2B.NH3C.HCl D.NaOH E.Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
| 实验步骤 | 实验现象 | 实验结论 |
同学们为了测定该纯碱样品的纯度,设计了如下实验.
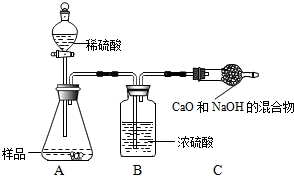
甲组:取10.0g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为
乙组:取10.0g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【查阅资料】
<资料1> 该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵。(“侯氏制碱法”
是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺。)
<资料2> 生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
<资料3> 部分生产流程如下图所示。

上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH= ▲ ↓+2NaCl;
![]() Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl;NH4Cl== NH3↑+HCl↑
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl;NH4Cl== NH3↑+HCl↑
<资料4>生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵
的混合物,其反应的化学方程式为:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl;分
离出固体产物,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方
程式为 ▲ 。
【问题讨论】
(1)溶液A中的溶质为 ▲ ,操作Ⅱ的名称为 ▲ 。
(2)上述生产流程中可循环使用的是 ▲ (填序号)。
A. CO2 B. NH3 C. HCl D.NaOH E. Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠。
| 实验步骤 | 实验现象 | 实验结论 |
| ▲ | ▲ | ▲ |
【含量测定】
研究小组的同学们为了测定该纯碱样品的纯度,设计了如下实验。
甲组:
取10.0 g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,
直至样品中无气泡冒出。充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9 g。样品中碳酸钠的质量分数为 ▲ (结果保留一位小数)。
乙组:
取10.0 g纯碱样品,利用右图所示装置,测出反应
后装置C增重了3.5 g(所加试剂均足量)。实验结束后,发现乙组测定的质量分数偏小,
其原因是 ▲ 。

查阅资料
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和氨气(NH3).
问题探究
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式
(2)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示)
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,化学小组同学设计了如下实验装置.
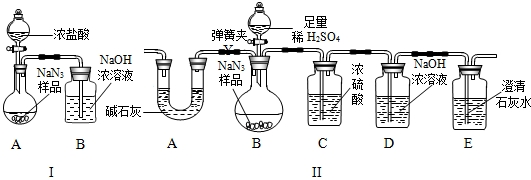
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用是
③根据装置II,小组同学设计的实验步骤有:a.称量装置D.b.称量样品,检查装置气密性.c.打开弹簧夹,鼓入空气.d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.其正确顺序为
[查阅资料]
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和氨气(NH3).
[问题探究]
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式:
| ||
| ||
(2)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示):
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,化学小组同学设计了如下实验装置.
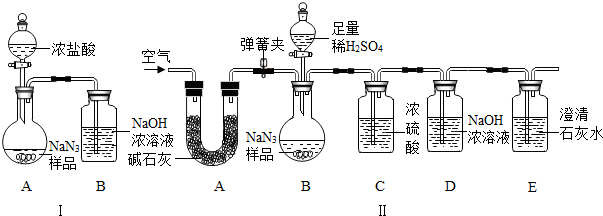
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D.
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
其正确顺序为
(4)该小组对某一工业级NaN3样品进行检测.取100克该样品于烧杯中,加水将其溶解,然后逐滴加入一定溶质质量分数的稀硫酸并不断振荡.
首先发生的反应是:2Na2CO3+H2SO4=2NaHCO3+Na2SO4;
然后发生的反应是:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑;
在上述过程中生成二氧化碳的质量与加入稀硫酸质量的关系如图甲所示.

①请你根据以上信息,在图乙的坐标系中画出检测过程中烧杯中溶液的质量随滴加硫酸溶液质量的变化曲线.
②计算该样品中纯碱的质量分数.