��Ŀ����
ijУ��ѧ��ȤС��ι��Ƽ���������Ϣ���������������о���[��������]
������1���ó����á������Ƽ�������Ļ�����ƷΪ�����ѧʽΪ
���������Ƽ�����ҹ�����������ѧ�Һ�°�����һ�����������������Ȼ�淋������Ƽ�գ���
������2������ԭ�ϴ����к����������������ʣ�MgCl2��CaCl2�������������ʣ�
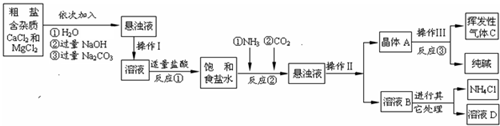
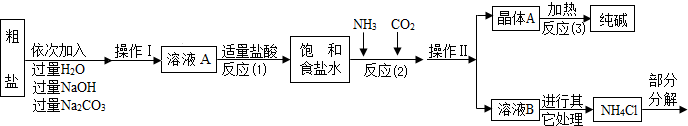
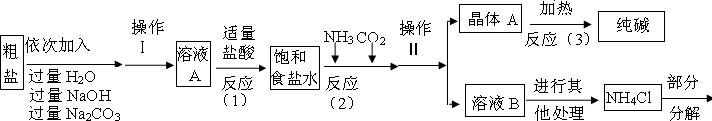
������3������������������ͼ��ʾ��
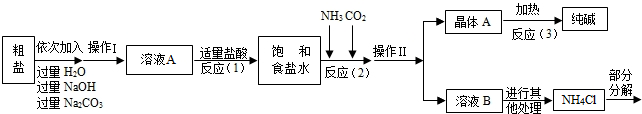
�����������漰�IJ��ַ�Ӧ�Ļ�ѧ����ʽΪ��MgCl2+2NaOH=Mg��OH��2��+2NaCl��
Na2CO3+CaCl2=CaCO3��+2NaCl��NH4Cl�TNH3��+HCl��
����ԭ������������NH3���Ͷ�����̼ͨ�뱥��ʳ��ˮ�еõ�С�մ���Ȼ�淋Ļ����䷴Ӧ�Ļ�ѧ����ʽΪ��NaCl��������Һ��+NH3+CO2+H2O=NaHCO3�����壩��+NH4Cl�������NaHCO3��ʹ�������ȼ��ɷֽ��Ƶô�����ֳ�����������˷�Ӧ�Ļ�ѧ����ʽΪ
���������ۡ�
��1����ҺA�е�����Ϊ
��2���������������п�ѭ��ʹ�õ���
A��CO2B��NH3C��HCl D��NaOH E��Na2CO3
��3������������Ϣ���������ʵ������̼���ƺ�̼�����ƣ�
| ʵ�鲽�� | ʵ������ | ʵ����� |
ͬѧ��Ϊ�˲ⶨ�ô�����Ʒ�Ĵ��ȣ����������ʵ�飮
���飺ȡ10.0g������Ʒ���ٶ�����������ʵ������в������仯���������м�����������ᣬֱ����Ʒ��������ð������ּ��������������ʲ������ȴ�����º���������ù�������Ϊ10.9g����Ʒ��̼���Ƶ���������Ϊ
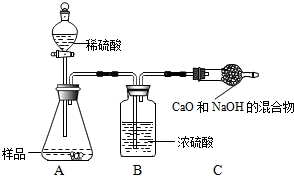
���飺ȡ10.0g������Ʒ��������ͼ��ʾװ�ã������Ӧ��װ��C������3.5g�������Լ�����������
ʵ�������������ⶨ����������ƫС����ԭ����
������[��������]������1������̼���Ƶ������ͻ�ѧʽ����д������д��
������3��������Ϣ�������NaHCO3��ʹ�������ȼ��ɷֽ��Ƶô�����ֳ������������д��
���������ۡ���1�����ݴ��εijɷּ����Ǻ��������ơ�̼���ƵȵĻ�ѧ���ʻش�ǰһ�գ����ݹ��˵�ԭ�������÷�Χ�ش��һ�գ�
��2�����������������漰�ķ���ʽ������ͼ�����ش�
��3������̼������̼�����Ʋ�ͬ�Ļ�ѧ���ʻش�
�������ⶨ�����飺���ù����봿����Ʒ��������ʵ���������ɵ��Ȼ�����̼���Ƶ�������ݴ˿ɸ��ݻ�ѧ����ʽ�����Ʒ��̼���Ƶ��������ټ���������������
���飺��������ⶨ����������ƫС����ֱ��ԭ����Cװ�������ٻش�
������3��������Ϣ�������NaHCO3��ʹ�������ȼ��ɷֽ��Ƶô�����ֳ������������д��
���������ۡ���1�����ݴ��εijɷּ����Ǻ��������ơ�̼���ƵȵĻ�ѧ���ʻش�ǰһ�գ����ݹ��˵�ԭ�������÷�Χ�ش��һ�գ�
��2�����������������漰�ķ���ʽ������ͼ�����ش�
��3������̼������̼�����Ʋ�ͬ�Ļ�ѧ���ʻش�
�������ⶨ�����飺���ù����봿����Ʒ��������ʵ���������ɵ��Ȼ�����̼���Ƶ�������ݴ˿ɸ��ݻ�ѧ����ʽ�����Ʒ��̼���Ƶ��������ټ���������������
���飺��������ⶨ����������ƫС����ֱ��ԭ����Cװ�������ٻش�
����⣺[��������]������1��������̼���Ƶ����������������Ӻ�̼������ӹ��ɣ��ƵĻ��ϼ�Ϊ+1��̼����Ļ��ϼ�Ϊ-2�����ݻ�������Ԫ�ػ��ϼ۵Ĵ�����Ϊ0���Լ�������ǰ�������ں��ԭ��ѧʽΪNa2CO3��
������3��������Ϣ�������NaHCO3��ʹ�������ȼ��ɷֽ��Ƶô�����ֳ����������֪����Ӧ��Ϊ̼�����ƣ������Ǽ��ȣ��������̼�����⣬�������ֳ��������������̼�����Ƶ�����ж�Ӧ��ˮ�Ͷ�����̼���ʷ���ʽΪ2NaHCO3
Na2CO3+H2O+CO2����
���������ۡ���1�������к����������������ʣ�MgCl2��CaCl2�����Ȼ�þ�����������Ʒ�Ӧ����������þ�������Ȼ��ƣ�
�Ȼ�������̼���Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ�����A�е�������Ҫ���Ȼ��ƣ������������ƺ�̼���ƹ�������ҺA��Ҳ���������ƺ�̼���ƣ������ǰѹ�����Һ��ֿ��IJ��������������ֳ��˾�������Һ������ͨ�����˲�����
��2�����������������漰�ķ���ʽ������ͼ�����ֶ�����̼���������Ȼ��⡢̼����Ϊ�ظ�ʹ�õ����ʣ�
��3��̼���ƻ�ѧ�����ȶ���̼�����������ֽ�����̼���ơ�ˮ��������̼����������̼��ʹ�����ʯ��ˮ����ǣ��ݴ˿����ʵ�飮
�������ⶨ�����飺
�⣺����Ʒ��̼���Ƶ�����ΪX��
Na2CO3+2HCl=2NaCl+H2O+CO2�� ������
106 117 11
X 10.9g-10.0g=0.9g
=
X=8.67g
��Ʒ��̼���Ƶ���������Ϊ
��100%=86.7%
���飺����ⶨ����������ƫС����ֱ��ԭ����Cװ�������٣�����ԭ�������ɵĶ�����̼����û�б�C�е��ռ���ȫ���գ�
�ʴ�Ϊ��
[��������]������1��Na2CO3��
������3��2NaHCO3
Na2CO3+H2O+CO2����
���������ۡ�
��1����NaCl��NaOH��Na2CO3���ڹ��ˣ�
��2��ABCE��
��3��
�������ⶨ��
���顢86.7%�����顢���ɵĶ�����̼����û�б�C�е��ռ���ȫ���գ�
������3��������Ϣ�������NaHCO3��ʹ�������ȼ��ɷֽ��Ƶô�����ֳ����������֪����Ӧ��Ϊ̼�����ƣ������Ǽ��ȣ��������̼�����⣬�������ֳ��������������̼�����Ƶ�����ж�Ӧ��ˮ�Ͷ�����̼���ʷ���ʽΪ2NaHCO3
| ||
���������ۡ���1�������к����������������ʣ�MgCl2��CaCl2�����Ȼ�þ�����������Ʒ�Ӧ����������þ�������Ȼ��ƣ�
�Ȼ�������̼���Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ�����A�е�������Ҫ���Ȼ��ƣ������������ƺ�̼���ƹ�������ҺA��Ҳ���������ƺ�̼���ƣ������ǰѹ�����Һ��ֿ��IJ��������������ֳ��˾�������Һ������ͨ�����˲�����
��2�����������������漰�ķ���ʽ������ͼ�����ֶ�����̼���������Ȼ��⡢̼����Ϊ�ظ�ʹ�õ����ʣ�
��3��̼���ƻ�ѧ�����ȶ���̼�����������ֽ�����̼���ơ�ˮ��������̼����������̼��ʹ�����ʯ��ˮ����ǣ��ݴ˿����ʵ�飮
�������ⶨ�����飺
�⣺����Ʒ��̼���Ƶ�����ΪX��
Na2CO3+2HCl=2NaCl+H2O+CO2�� ������
106 117 11
X 10.9g-10.0g=0.9g
| 106 |
| 11 |
| X |
| 0.9g |
X=8.67g
��Ʒ��̼���Ƶ���������Ϊ
| 8.67g |
| 10.0g |
���飺����ⶨ����������ƫС����ֱ��ԭ����Cװ�������٣�����ԭ�������ɵĶ�����̼����û�б�C�е��ռ���ȫ���գ�
�ʴ�Ϊ��
[��������]������1��Na2CO3��
������3��2NaHCO3
| ||
���������ۡ�
��1����NaCl��NaOH��Na2CO3���ڹ��ˣ�
��2��ABCE��
��3��
| ʵ�鲽�� | ʵ������ | ʵ����� |
| ȡ������Ʒ�е�һ�ַ����Թ��У����ϴ����ܵĵ����������ܵ���һ����������ʯ��ˮ�У����ȹ��岢�۲����� | ������ɫ���ݣ������ʯ��ˮ����� | ����Ʒ��̼�����ƣ���һ����̼���� |
���顢86.7%�����顢���ɵĶ�����̼����û�б�C�е��ռ���ȫ���գ�
���������⿼�����ÿα�֪ʶ����������������ܼ���ѧ���Կα�֪ʶ�����⣬ѵ��ѧ����˼ά������

��ϰ��ϵ�д�
�����Ŀ
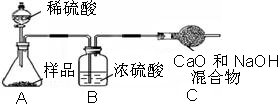 С�������������������ʸ����ȴ�����º�Ƶù�������Ϊ13.1g����Ʒ��̼���Ƶ���������Ϊ
С�������������������ʸ����ȴ�����º�Ƶù�������Ϊ13.1g����Ʒ��̼���Ƶ���������Ϊ