网址:http://m.1010jiajiao.com/timu3_id_1232328[举报]
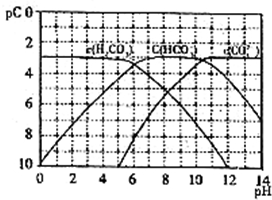 pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol?L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-
pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol?L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pC、pH图.请回答下列问题:
(1)在pH=9时,H2CO3溶液中浓度最大的含碳元素的离子为
(2)pH<4时,溶液中H2CO3的pC总是约等于3的原因是
(3)已知M2CO3为难溶物,则其Ksp的表达式为

请回答下列问题:
(1)pH=2~4时,H2CO3溶液中主要存在的离子为
(2)已知碳酸溶液中存在平衡:H2O+CO2?H2CO3?H++HCO3-.当溶液pH由5减小到0时,溶液中H2CO3的pC基本不变的原因是
(3)能够抵抗外来少量酸碱的影响、保持自身 pH变化不大的溶液,称之为缓冲溶液.如浓度均为0.1mol?L-1的NaHCO3和Na2CO3混合溶液就是一种缓冲溶液,加入少量酸或碱,由于平衡HCO3-?H++CO32-移动,溶液中H+浓度变化不大.根据上述信息,下列不能形成缓冲溶液的是
A.碳酸钠和氢氧化钠的混和溶液 B.醋酸和醋酸钠的混和溶液
C.硫酸和硫酸钠的混合溶液 D.氨水和氯化铵的混和溶液. 查看习题详情和答案>>

_____________________(用方程式表示)。
(2)H2CO3一级电离平衡常数的数值Ka1≈_____________
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确_______________。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1。c(CO32-)=0.075 mol·L-1若t1时刻在上述体系中加入100 mL0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
(5)请画出t1时刻后Li+和CO32-浓度随时间变化关系图(用虚线表示Li+ ,实线表示CO32-)。
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中该溶质的pC=-lg1×10-3=3。已知H2CO3溶液中存在的化学平衡为:CO2+H2O![]() H2CO3
H2CO3![]() H+ +HCO3—;HCO3—
H+ +HCO3—;HCO3—![]() H++CO32—。如图为H2CO3溶液的pC-pH图。请回答下列问题:
H++CO32—。如图为H2CO3溶液的pC-pH图。请回答下列问题:

(1)在pH=0~4时,H2CO3溶液中主要存在的离子为: ;在pH=12时,H2CO3溶液中主要存在的含碳阴离子为: ;
(2)pH<5时,溶液中H2CO3的pC值总是约等于3的原因是 ;
(3)一定浓度的NaHCO3和Na2CO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是
查看习题详情和答案>>pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值,如溶液中某溶质的浓度为:1×10-3 mol·L-1,则pC=-lg(1×10ˉ3)=3.某温度下,H2CO3溶液的pC-pH关系如图.
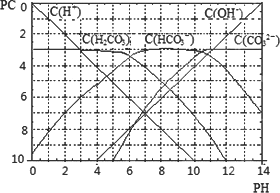
请回答下列问题:
(1)pH=2~4时,H2CO3溶液中主要存在的离子为________;
(2)求此温度下H2CO3![]() H++HCO3-的电离平衡常数________;
H++HCO3-的电离平衡常数________;
(3)能够抵抗外来少量酸碱的影响、保持自身pH变化不大的溶液,称之为缓冲溶液.如浓度均为0.1 mol·L-1的NaHCO3和Na2CO3混合溶液就是一种缓冲溶液,加入少量酸或碱,由于平衡HCO3-![]() H++CO32-移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液________.
H++CO32-移动,溶液中H+浓度变化不大.根据上述信息,确定氨水和氯化铵的混和溶液能不能形成缓冲溶液________.