题目内容
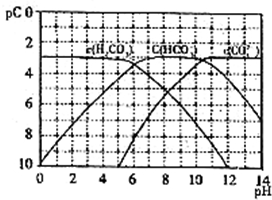 pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol?L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-
pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol?L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pC、pH图.请回答下列问题:
(1)在pH=9时,H2CO3溶液中浓度最大的含碳元素的离子为
(2)pH<4时,溶液中H2CO3的pC总是约等于3的原因是
(3)已知M2CO3为难溶物,则其Ksp的表达式为
分析:(1)根据pC概念知,pC值越大,该溶质浓度越小,反之,pC值越小,其微粒浓度越大,根据图象分析判断;
(2)氢离子浓度越大,越抑制碳酸电离;导致有二氧化碳生成;
(3)Ksp=c2(M+)?c(CO32-);根据溶度积常数计算溶液中c(CO32-),再根据pC概念计算pC值.
(2)氢离子浓度越大,越抑制碳酸电离;导致有二氧化碳生成;
(3)Ksp=c2(M+)?c(CO32-);根据溶度积常数计算溶液中c(CO32-),再根据pC概念计算pC值.
解答:解:(1)根据pC概念知,pC值越大,该溶质浓度越小,反之,pC值越小,其微粒浓度越大,根据图象知,pH=9时,pC最小的是HCO3-,所以HCO3-浓度最大,故答案为:HCO3-;
(2)pH<4时,溶液中,c(H+)增大后,H2CO3?H++HCO3-平衡向左移动放出CO2,导致碳酸浓度不变,碳酸为饱和溶液,所以溶液中H2CO3的pC总是约等于3,故答案为:c(H+)增大后,H2CO3?H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变;
(3)Ksp=c2(M+)?c(CO32-);溶液中c(CO32-)=
=
mol/L=0.01mol/L,则pC=-lg0.01=2,
故答案为:Ksp=c2(M+)?c(CO32-);2.
(2)pH<4时,溶液中,c(H+)增大后,H2CO3?H++HCO3-平衡向左移动放出CO2,导致碳酸浓度不变,碳酸为饱和溶液,所以溶液中H2CO3的pC总是约等于3,故答案为:c(H+)增大后,H2CO3?H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变;
(3)Ksp=c2(M+)?c(CO32-);溶液中c(CO32-)=
| Ksp |
| c2(M+) |
| 1.0×10-12 |
| (1×10-5)2 |
故答案为:Ksp=c2(M+)?c(CO32-);2.
点评:本题考查了弱电解质的电离、pC的计算,明确pC的概念是解本题关键,可以采用知识迁移的方法分析pC概念,再利用溶度积常数等知识点来分析解答,题目难度中等.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol?L-1,则该溶液中溶质的pC=3.下列表达正确的是( )
| A、某温度下任何电解质的水溶液中,pC(H+)+pC(OH-)=14 | B、0.01mol/L的CaCl2溶液中逐渐滴加纯碱溶液,滴加过程中pC(Ca2+)逐渐减小 | C、用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大 | D、某温度下,AB难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中pC(A+)+pC(B-)=10 |
 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
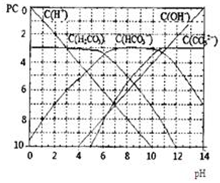 pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题: