摘要:27.主族单质A.B.C有如下转化关系.常温下B是有色气体.A为金属.在化合物F中.A元素以A2+方式存在. A2+有5个电子层.且最外层有两个电子. 试回答下列问题: (1)A元素在周期表中位置为 (2)用电子式表示E的形成过程 (3)写出反应③的离子方程式. (4)测得0.1mol/L的D溶液的pH<7.且固体D遇水蒸气立刻产生白雾. ①用广泛pH试纸测pH的操作是 ②如何用D固体配D溶液? ③同温度下.pH相等的D溶液和E溶液中.水的电离程度的关系是D E(填“大于 .“小于 或“等于 ).
网址:http://m.1010jiajiao.com/timu3_id_1229986[举报]
 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.己知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.(1)C元素在周期表中的位置
第三周期、第 VIIA族
第三周期、第 VIIA族
.(2)A元素与水反应的离子方程式是
2Na+2H2O=2Na++2OH-+H2↑
2Na+2H2O=2Na++2OH-+H2↑
.(3)写出C元素的单质从A、B两元素组成的化合物的水溶液中置换出B元素的单质的化学方程式
Cl2+Na2S=2NaCl+S↓
Cl2+Na2S=2NaCl+S↓
.(4)BD2和C2均具有漂白性,二者的漂白原理
不同
不同
.(填“相同”或“不同”)(5)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:3H2+N2
 2NH3△H=-92.4kJ?mol-1
2NH3△H=-92.4kJ?mol-1①当合成氨反应达到平衡后,改变某一外界条件 (不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.图中t1时引起平衡移动的条件可能是
加压
加压
,其中表示平衡混合物中NH3的含量最高的一段时间是t2-t3
t2-t3
.②温度为T℃时,将2a molH2和a molN2放入0.5L 密闭容器中,充分反应后测得N2的转化率为50%.则该反应的平衡常数为
| 4 |
| a2 |
| 4 |
| a2 |
 A、B、C、D、E、F六神物质的相互转化关系如下图所示(反应条件末标出),其中反应①是置换反应.
A、B、C、D、E、F六神物质的相互转化关系如下图所示(反应条件末标出),其中反应①是置换反应.(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是:
2C+SiO2
2CO+Si
| ||
2C+SiO2
2CO+Si
.
| ||
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是:
2Fe+Cl2=2Fe3+
2Fe+Cl2=2Fe3+
;A元素在于周期表中的位置是第四周期,第ⅤⅢ族
第四周期,第ⅤⅢ族
.(3)若B、C、F都是气态单质,且B有毒;③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则该白烟物质的电子式是


4NH3+O2
4NO+6H2O
| ||
| △ |
4NH3+O2
4NO+6H2O
.
| ||
| △ |
(4)若A、D为短周期元素单质,且A为固体金属单质,D为固体非金属单质,③和④两个反应中都有红棕色气体生成,则反应④的化学方程式是:
C+4HNO3
4NO2↑+CO2↑+2H2O
| ||
C+4HNO3
4NO2↑+CO2↑+2H2O
.
| ||
 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,A的原子在周期表中半 径最小,A、D伺主族,可形成离子化合物DA;C、F同主族,可形成FC2,FC3两种分子B,D,E 三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,所得盐中均含C元 素.请填写下列空白:(1)C在元素周期表中的位置为
(2)F单质的燃烧热△H=-akJ/mol,写出表示F单质的燃烧热的热化学方程式
(3)E单质与D的最高价氧化物的水化物的溶液反应的离子方程式为
(4)A、B两元素可形成离子化合物BA5,其电子式为
(5)将0.4mol FC2和0.2mol C2放入容积为2L的_密闭容器中,在一定条件下发生 反应2FC2+C2?2FC3,当FC2百分含量不变时,得到0.2mol FC3气体,则此时反应的平衡常数K=
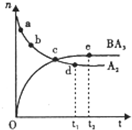
(6)向一绝热恒容密闭容器中通入B2和A2,在一定条件下发生反应B2(g)+3A2(g)?2BA3(g)△H<0,达到平衡,n(A2)和n(BA3)随时间变化的关系如图所示.下列有关叙述一定正确的是
A.c点表示BA3生成速率与BA3分解速率相等
B.c点和e点 A2的转化率相等
C.平衡后再升高温度,不利于BA3的合成
D.d点时:n(A2):n(BA3)=3:2
(7)将E元素的单质(除去氧化膜)投入浓的氯化铜溶液中,在其表面很 快出现一层红色物质,产生气体的速率逐渐加快,经检验,该气体为氢气,用温度计测得溶液的温度迅速升高.请从有关能量、是否有电化学作用等方面,分析能产生氢气且开始 阶段的速率不断加快的原因
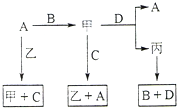 A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:
A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空: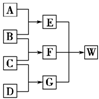 A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).
A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).