题目内容
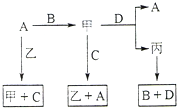 A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:
A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,乙在常温下为无色无味的液体,各备物质间转化关系如图:(反应条件已略去),请填空:(1)组成A单质的元素位于周期表第
(2)A 和乙反应的化学方程式
(3)甲和D反应的化学方程式
(4)D与烧碱溶液反应的离子方程式
(5)A与稀硫酸反应生成的硫酸盐可用于治疗某些类型的贫血症.该硫酸盐制成药片时,外表包有一层特殊的糖衣,这层糖衣的主要作用是
分析:A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,由A+B→甲可知,甲为二元化合物,乙在常温下为无色无味的液体,应为H2O,单质A与水反应生成化合物甲和单质C,推知C应为H2,甲应为氧化物,而甲又可与H2反应生成单质A和水,可判断A为Fe、B为O2、甲为Fe3O4.由Fe3O4与单质D反应生成化合物丙(氧化物)和Fe,而电解丙生成O2和单质D,可推知D为Al,则丙为Al2O3.
解答:解:A、B、C、D 是中学化学常见的四种单质,甲、乙、丙为三种化合物,由A+B→甲可知,甲为二元化合物,乙在常温下为无色无味的液体,应为H2O,单质A与水反应生成化合物甲和单质C,推知C应为H2,甲应为氧化物,而甲又可与H2反应生成单质A和水,可判断A为Fe、B为O2、甲为Fe3O4.由Fe3O4与单质D反应生成化合物丙(氧化物)和Fe,而电解丙生成O2和单质D,可推知D为Al,则丙为Al2O3,
(1)由以上分析可知A为Fe,位于周期表第四周期第Ⅷ族,乙为H2O,为共价化合物,电子式为 ,
,
故答案为:四、Ⅷ; ;
;
(2)铁和水在高温下反应生成Fe3O4和H2,反应的化学方程式为3Fe+4H2O(g)
Fe3O4+4H2,
故答案为:3Fe+4H2O(g)
Fe3O4+4H2;
(3)甲和D的反应为铝热反应,反应的化学方程式为8Al+3Fe3O4
9Fe+4Al2O3,
故答案为:8Al+3Fe3O4
9Fe+4Al2O3;
(4)Al与烧碱反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)Fe与稀硫酸反应生成的硫酸盐可用于治疗某些类型的贫血症,为硫酸亚铁,但硫酸亚铁不稳定,易被氧化,在表面包有一层特殊的糖衣,可起到防止Fe2+被氧化的作用,
故答案为:防止Fe2+被氧化.
(1)由以上分析可知A为Fe,位于周期表第四周期第Ⅷ族,乙为H2O,为共价化合物,电子式为
 ,
,故答案为:四、Ⅷ;
 ;
;(2)铁和水在高温下反应生成Fe3O4和H2,反应的化学方程式为3Fe+4H2O(g)
| ||
故答案为:3Fe+4H2O(g)
| ||
(3)甲和D的反应为铝热反应,反应的化学方程式为8Al+3Fe3O4
| ||
故答案为:8Al+3Fe3O4
| ||
(4)Al与烧碱反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)Fe与稀硫酸反应生成的硫酸盐可用于治疗某些类型的贫血症,为硫酸亚铁,但硫酸亚铁不稳定,易被氧化,在表面包有一层特殊的糖衣,可起到防止Fe2+被氧化的作用,
故答案为:防止Fe2+被氧化.
点评:本题考查无机物的推断,侧重于学生的分析能力和元素化合物知识的综合运用的考查,为高考常见题型和高频考点,注意把握推断题的突破口,抓住物质的性质为解答该题的关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
|
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如表:
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能原因是 .
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示).
②M是含有 键的 分子(填“极性”或“非极性”)
③N是一种易液化的气体,请简述其易液化的原因 .
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 .
⑤AB-离子中和B2分子的π键数目比为 .
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E元素组成的单质的晶体堆积模型为 (填代号)
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为 .
③G2+离子的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 .
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2754 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①A、B、C的第一电离能由小到大的顺序为
②M是含有
③N是一种易液化的气体,请简述其易液化的原因
④W分子的VSEPR模型的空间构型为
⑤AB-离子中和B2分子的π键数目比为
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E元素组成的单质的晶体堆积模型为
a.简单立方堆积 b.体心立方堆积 c.六方最密堆积 d.面心立方最密堆积
②F元素在其化合物中最高化合价为
③G2+离子的核外电子排布式为
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 ,下列比较中正确的是( )
,下列比较中正确的是( ) 如图中A、B、C、D是同周期或同主族的相邻元素:
如图中A、B、C、D是同周期或同主族的相邻元素: