网址:http://m.1010jiajiao.com/timu3_id_118826[举报]
我国是一个水资源短缺的国家,水资源的分布在时间和地区上极不平衡,黄河、淮河流域经流水量占全国6.5%,耕地却占40%;长江流域经流水量占80%,耕地却不足40%,于是我国在2002年12月27日正式启动“南水北调”工程,以改善华北地区的缺水紧张,因此沿途水渠要加强保护.据此请回答下列问题:
(1)海水、河水、湖水、雨水都是天然水,天然水属
天然水需经净化才能饮用,下面是自来水厂净水流程为:天然水
| 加絮凝 |
| 消毒剂 |
其中常用的絮凝剂是
(2)若要粗略测定某水源的酸碱度时,可用
(3)保护某水源的下列做法中,正确的是
A.在引水渠岸边放垃圾 B.向引水渠中排放工业废水
C.在引水渠两岸植树 D.向引水渠中倾倒生活污水
E.把引水渠中的水引入被污染的湖泊中,使湖中死水变活
(4)举出两种利用水贮存太阳能的方法①
(5)水既普通又宝贵,请你归纳一下我们学过的水有哪些方面的化学性质,用不同的反应类型化学方程式表示:
分解反应(1)
| ||
| ||
(6)长期饮用硬水对人体健康不利,一些工业用水也不能用硬水.家庭中将硬水变成软
水的操作方法是
请参与有关水的问题的讨论:
我国是一个水资源短缺的国家,水资源的分布在时间和地区上极不平衡,黄河、淮河流域经流水量占全国6.5%,耕地却占40%;长江流域经流水量占80%,耕地却不足40%,于是我国在2002年12月27日正式启动“南水北调”工程,以改善华北地区的缺水紧张,因此沿途水渠要加强保护.据此请回答下列问题:
(1)海水、河水、湖水、雨水都是天然水,天然水属______物.
天然水需经净化才能饮用,下面是自来水厂净水流程为:天然水 沉降→过滤→吸附
沉降→过滤→吸附 自来水,
自来水,
其中常用的絮凝剂是______,吸附剂一般用______.自来水一 般用少量的氯气来消毒,而氯气与水会发生反应:Cl2+H2O=HCl+HClO,若用自来水来配制50%氢氧化钠浓溶液,则会使配制的溶液溶质质量分数偏______(填“大”或“小”).
(2)若要粗略测定某水源的酸碱度时,可用______来测定.
(3)保护某水源的下列做法中,正确的是______.
A.在引水渠岸边放垃圾 B.向引水渠中排放工业废水
C.在引水渠两岸植树 D.向引水渠中倾倒生活污水
E.把引水渠中的水引入被污染的湖泊中,使湖中死水变活
(4)举出两种利用水贮存太阳能的方法①______,②______.
(5)水既普通又宝贵,请你归纳一下我们学过的水有哪些方面的化学性质,用不同的反应类型化学方程式表示:
分解反应(1)______;化合反应(2)______.
(6)长期饮用硬水对人体健康不利,一些工业用水也不能用硬水.家庭中将硬水变成软
水的操作方法是______;常用铝壶烧这种水会形成较多的水垢,可采用______的方法将其除去.
查看习题详情和答案>>
|
某校化学兴趣小组参观制碱厂后获得以下信息,并对相关问题进行研究。 | ||||||
 | ||||||
| 上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH==Mg(OH)2↓ +2NaCl;Na2CO3+CaCl2==CaCO3↓+2NaCl;NH4Cl==NH3↑+HCl↑。生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O==NaHCO3(晶体)↓+NH4Cl4分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为______________________________________________。 【问题讨论】(2)溶液A中的溶质为________,操作Ⅱ的名称为_____________。 (3)上述生产流程中可循环使用的是____ (填序号)。 A.CO2;B.NH3;C.HCl;D.NaOH;E.Na2CO3 (4)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠: | ||||||
| ||||||
|
【含量测定】同学们为了测定该纯碱样品的纯度,设计了如下实验。 | ||||||
 |
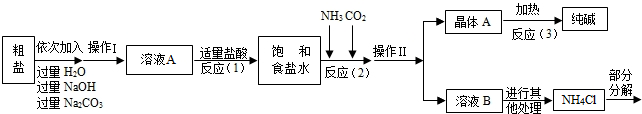
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【查阅资料】
<资料1> 该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵。(“侯氏制碱法”
是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺。)
<资料2> 生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
<资料3> 部分生产流程如下图所示。

上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH= ▲ ↓+2NaCl;
![]() Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl;NH4Cl== NH3↑+HCl↑
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl;NH4Cl== NH3↑+HCl↑
<资料4>生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵
的混合物,其反应的化学方程式为:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl;分
离出固体产物,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方
程式为 ▲ 。
【问题讨论】
(1)溶液A中的溶质为 ▲ ,操作Ⅱ的名称为 ▲ 。
(2)上述生产流程中可循环使用的是 ▲ (填序号)。
A. CO2 B. NH3 C. HCl D.NaOH E. Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠。
| 实验步骤 | 实验现象 | 实验结论 |
| ▲ | ▲ | ▲ |
【含量测定】
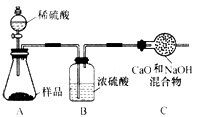
研究小组的同学们为了测定该纯碱样品的纯度,设计了如下实验。
甲组:
取10.0 g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,
直至样品中无气泡冒出。充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9 g。样品中碳酸钠的质量分数为 ▲ (结果保留一位小数)。
乙组:
取10.0 g纯碱样品,利用右图所示装置,测出反应
后装置C增重了3.5 g(所加试剂均足量)。实验结束后,发现乙组测定的质量分数偏小,
其原因是 ▲ 。

[查阅资料]
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为
(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示.
上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(晶体)↓+NH4Cl;分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为
【问题讨论】
(1)溶液A中的溶质为
(2)上述生产流程中可循环使用的是
A.CO2B.NH3C.HCl D.NaOH E.Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
| 实验步骤 | 实验现象 | 实验结论 |
同学们为了测定该纯碱样品的纯度,设计了如下实验.
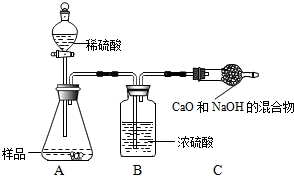
甲组:取10.0g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为
乙组:取10.0g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是