题目内容
请参与有关水的问题的讨论:
我国是一个水资源短缺的国家,水资源的分布在时间和地区上极不平衡,黄河、淮河流域经流水量占全国6.5%,耕地却占40%;长江流域经流水量占80%,耕地却不足40%,于是我国在2002年12月27日正式启动“南水北调”工程,以改善华北地区的缺水紧张,因此沿途水渠要加强保护.据此请回答下列问题:
(1)海水、河水、湖水、雨水都是天然水,天然水属______物.
天然水需经净化才能饮用,下面是自来水厂净水流程为:天然水 沉降→过滤→吸附
沉降→过滤→吸附 自来水,
自来水,
其中常用的絮凝剂是______,吸附剂一般用______.自来水一 般用少量的氯气来消毒,而氯气与水会发生反应:Cl2+H2O=HCl+HClO,若用自来水来配制50%氢氧化钠浓溶液,则会使配制的溶液溶质质量分数偏______(填“大”或“小”).
(2)若要粗略测定某水源的酸碱度时,可用______来测定.
(3)保护某水源的下列做法中,正确的是______.
A.在引水渠岸边放垃圾 B.向引水渠中排放工业废水
C.在引水渠两岸植树 D.向引水渠中倾倒生活污水
E.把引水渠中的水引入被污染的湖泊中,使湖中死水变活
(4)举出两种利用水贮存太阳能的方法①______,②______.
(5)水既普通又宝贵,请你归纳一下我们学过的水有哪些方面的化学性质,用不同的反应类型化学方程式表示:
分解反应(1)______;化合反应(2)______.
(6)长期饮用硬水对人体健康不利,一些工业用水也不能用硬水.家庭中将硬水变成软
水的操作方法是______;常用铝壶烧这种水会形成较多的水垢,可采用______的方法将其除去.
解:(1)由天然水中含有可溶性、不可溶性等杂质,天然水属混合物;天然水在净化时常用的絮凝剂是明矾,吸附剂一般用活性炭.在杀菌消毒时用少量的氯气来消毒,而氯气与水会发生反应:Cl2+H2O=HCl+HClO.若用自来水来配制50%氢氧化钠浓溶液,由于氢氧化钠能与盐酸和次氯酸反应,则会使配制的溶液溶质质量分数偏小;
(2)若要粗略测定某水源的酸碱度时,可用pH试纸来测定;
(3)A.在引水渠岸边放垃圾,会造成水的污染.故A错误;
B.向引水渠中排放工业废水会造成水的污染.故B错误;
C.在引水渠两岸植树,不会造成水的污染.故C正确;
D.向引水渠中倾倒生活污水,会造成水的污染.故D错误;
(4)利用水贮存太阳能的方法较多.例如:太阳能热水器.水的蒸发,太阳能分解水等;
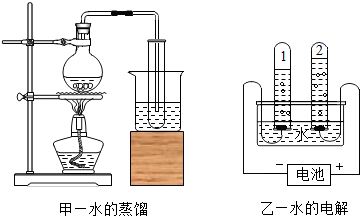
(5)由水的性质可知,水在通电条件下能分解成氢气和氧气,水能氧化钙等物质发生化合反应.反应的方程式是:(1)分解反应:2H2O 2H2↑+O2↑;化合反应:(2)CaO+H2O═Ca(OH)2.
2H2↑+O2↑;化合反应:(2)CaO+H2O═Ca(OH)2.
(6)长期饮用硬水对人体健康不利,家庭中将硬水变成软水的操作方法是煮沸;常用铝壶烧这种水会形成较多的水垢,水垢的主要成分碳酸钙和氢氧化镁等,能与酸反应,可采用加稀醋酸的方法将其除去.
故答为:(1)混合,明矾,活性炭,小;(2)pH试纸(3)C;(4)太阳能热水器.水的蒸发;5)2H2O 2H2↑+O2↑CaO+H2O═Ca(OH)2.(6)加稀醋酸.
2H2↑+O2↑CaO+H2O═Ca(OH)2.(6)加稀醋酸.
分析:(1)根据天然水的组成分析类别;物质的性质决定物质的用途,根据物质的性质分析净化水的物质,根据自来水中含有的盐酸、次氯酸的性质分析配置的氢氧化钠的溶质质量分数的变化;
(2)pH试纸能粗略地测定溶液的酸碱度;
(3)根据水的污染源分析保护谁的措施;
(4)根据水的性质分析储存太阳能发的方法;
(5)根据水在通电条件下能分解成氢气和氧气,水能氧化钙等物质发生化合反应写出反应的方程式;
(6)根据硬水软化的方法和水垢的性质分析回答.
点评:本题比较全面地考查了有关水的知识,但难度不大.只有加强有关水的知识的学习,才能较好地完成有关的问题.
(2)若要粗略测定某水源的酸碱度时,可用pH试纸来测定;
(3)A.在引水渠岸边放垃圾,会造成水的污染.故A错误;
B.向引水渠中排放工业废水会造成水的污染.故B错误;
C.在引水渠两岸植树,不会造成水的污染.故C正确;
D.向引水渠中倾倒生活污水,会造成水的污染.故D错误;
(4)利用水贮存太阳能的方法较多.例如:太阳能热水器.水的蒸发,太阳能分解水等;
(5)由水的性质可知,水在通电条件下能分解成氢气和氧气,水能氧化钙等物质发生化合反应.反应的方程式是:(1)分解反应:2H2O
 2H2↑+O2↑;化合反应:(2)CaO+H2O═Ca(OH)2.
2H2↑+O2↑;化合反应:(2)CaO+H2O═Ca(OH)2.(6)长期饮用硬水对人体健康不利,家庭中将硬水变成软水的操作方法是煮沸;常用铝壶烧这种水会形成较多的水垢,水垢的主要成分碳酸钙和氢氧化镁等,能与酸反应,可采用加稀醋酸的方法将其除去.
故答为:(1)混合,明矾,活性炭,小;(2)pH试纸(3)C;(4)太阳能热水器.水的蒸发;5)2H2O
 2H2↑+O2↑CaO+H2O═Ca(OH)2.(6)加稀醋酸.
2H2↑+O2↑CaO+H2O═Ca(OH)2.(6)加稀醋酸.分析:(1)根据天然水的组成分析类别;物质的性质决定物质的用途,根据物质的性质分析净化水的物质,根据自来水中含有的盐酸、次氯酸的性质分析配置的氢氧化钠的溶质质量分数的变化;
(2)pH试纸能粗略地测定溶液的酸碱度;
(3)根据水的污染源分析保护谁的措施;
(4)根据水的性质分析储存太阳能发的方法;
(5)根据水在通电条件下能分解成氢气和氧气,水能氧化钙等物质发生化合反应写出反应的方程式;
(6)根据硬水软化的方法和水垢的性质分析回答.
点评:本题比较全面地考查了有关水的知识,但难度不大.只有加强有关水的知识的学习,才能较好地完成有关的问题.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目