摘要:[参考答案]由不饱和一饱和 (3)变小 [思维点拨]解析:本题考查的是溶解度曲线的识别.解题关键是读懂溶解度曲线图.看清楚几个点的变化.(1)由甲物质的溶解度曲线图可知甲的溶解度随温度升高而增大.Tl℃时甲物质的溶解度小于10g.(2)A点位于曲线的下方是甲的不饱和溶液. B点正好位于溶解度曲线上.是饱和溶液.当温度由T3-T2时甲溶液由A-B的变化是由不饱和一饱和.(3)T2时的溶解度大于T1时的溶解度.T2-T1时甲溶液由B-C会有晶体甲析出.因此溶质的质量分数会减小.
网址:http://m.1010jiajiao.com/timu3_id_10836[举报]
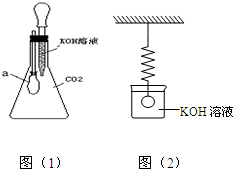 (2005?卢湾区二模)氢氧化钙是一种碱,二氧化碳能与氢氧化钙溶液反应.氢氧化钾也是碱.那么,二氧化碳能否与氢氧化钾溶液也发生反应?
(2005?卢湾区二模)氢氧化钙是一种碱,二氧化碳能与氢氧化钙溶液反应.氢氧化钾也是碱.那么,二氧化碳能否与氢氧化钾溶液也发生反应?按照该思想方法,学生小组设计如右图(1)装置作探究:
锥形瓶内收满二氧化碳,滴管内盛有氢氧化钾溶液.挤压胶头滴管将氢氧化钾溶液滴入锥形瓶中.振荡后可见小气球a明显膨胀.
(1)反应原理:
CO2+2KOH=K2CO3+H2O
CO2+2KOH=K2CO3+H2O
.(2)试分析原因:
二氧化碳与氢氧化钾反应,使瓶内气体压强减小,大气压把气球鼓起
二氧化碳与氢氧化钾反应,使瓶内气体压强减小,大气压把气球鼓起
.(3)在以上实验后锥形瓶内的液体中滴加无色酚酞,显
红
红
色.接着以上学生实验,教师提供如图(2)所示装置:一只较灵敏的弹簧秤下,悬挂着一个实心的铜球,铜球浸没在盛有氢氧化钾溶液的烧杯中,此时弹簧秤的读数为M.教师请学生根据以上探究已有的结论推测:
(4)将烧杯敞开放置在空气中数天后,弹簧秤的读数将
小于M
小于M
.(假设溶液体积不变,且没有沉淀生成)(填“大于M”、“小于M”、“等于M”或“不能判断”)(5)因为:
烧杯敝开放置在空气中数天后,烧杯中氢氧化钾溶液吸收空气中二氧化碳而生成碳酸钾,使溶液质量增加,溶液体积不变而质量增加,根据ρ=
,可判断溶液密度增大,再根据F浮=ρ液V铜球g,可知铜球所受浮力增大,最后由弹簧秤的读数=G铜球-F浮,可得知此时弹簧秤的读数将小于M.
| m |
| v |
烧杯敝开放置在空气中数天后,烧杯中氢氧化钾溶液吸收空气中二氧化碳而生成碳酸钾,使溶液质量增加,溶液体积不变而质量增加,根据ρ=
,可判断溶液密度增大,再根据F浮=ρ液V铜球g,可知铜球所受浮力增大,最后由弹簧秤的读数=G铜球-F浮,可得知此时弹簧秤的读数将小于M.
.| m |
| v |
20、下图是元素周期表中部分元素的信息,请回答下列问题:
(1)每一横行元素从左向右排列所遵循的一条规律是
(2)表中X=
查看习题详情和答案>>
| 第2周期 | 3 Li 6.991 |
4 Be 9.012 |
5 B 10.81 |
6 C 12.01 |
7 N 14.01 |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 |
| 第3周期 | 11 Na 22.99 |
12 Mg 24.31 |
13 Al 26.98 |
14 Si 28.09 |
15 P 30.97 |
16 S 32.02 |
17 Cl 35.45 |
X Ar 39.95 |
原子序数(核电荷数)依次增大(或由金属逐渐过渡到非金属)(其他答案合理即可)
.(2)表中X=
18
,从分类上看它属于非金属(或稀有气体)
元素.向40g 10%的氢氧化钠溶液中滴加49g 10%的稀硫酸,则溶液的pH的变化过程是
[ ]
A.由小于7逐渐增大
B.由大于7逐渐减小至等于7
C.由小于7逐渐增大至大于7
D.由大于7逐渐减小变为小于7
查看习题详情和答案>>19、元素周期律和周期表是学习化学的重要工具,下表是元素周期表的部分信息.

请认真分析表中信息,回答下列问题:
(1)地壳中含量仅次于氧的非金属元素名称是
(2) 所表示的粒子符号为
所表示的粒子符号为
(3)由原子序数为8和13的两种元素组成的化合物是
(4)元素周期表同一横行元素的排列规律是:从左至右
查看习题详情和答案>>

请认真分析表中信息,回答下列问题:
(1)地壳中含量仅次于氧的非金属元素名称是
硅
,该元素原子的质子数为14
.(2)
 所表示的粒子符号为
所表示的粒子符号为S
,它的最外层电子数为6
.(3)由原子序数为8和13的两种元素组成的化合物是
Al2O3
(写化学式).(4)元素周期表同一横行元素的排列规律是:从左至右
原子序数(核电荷数)依次增大(或由金属逐渐过渡到非金属)
. (2012?兰州)A、B、C、D、E是初中化学中常见的不同类别的物质(物质按单质、氧化物、酸、碱、盐分类).已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐.图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去).回答下列问题:
(2012?兰州)A、B、C、D、E是初中化学中常见的不同类别的物质(物质按单质、氧化物、酸、碱、盐分类).已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐.图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去).回答下列问题:(1)写出下列物质的化学式:A
Fe
Fe
,ENa2CO3(或K2CO3)
Na2CO3(或K2CO3)
.(2)由E转化为B的化学方程式为
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(或K2CO3+Ca(OH)2=CaCO3↓+2KOH等其他合理答案即可)
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(或K2CO3+Ca(OH)2=CaCO3↓+2KOH等其他合理答案即可)
;由C转化为A的原理在工业上常用于炼铁
炼铁
.