2009届浙江省台州中学高三上学期期中试题化学(理科)
命题人:胡琴凤 审题人:王士凯
可能用到的相对原子质量:H
一、选择题(每小题只有一个正确选项,每题2分,共50分)
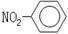
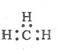 2.下列各项表达中正确的是
2.下列各项表达中正确的是
A.一CH3(甲基)的电子式为: B.硝基苯的结构简式:
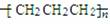
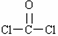 C.光气COCl2的结构式:
D.聚丙烯的结构简式:
C.光气COCl2的结构式:
D.聚丙烯的结构简式:
3.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反 应:Tl3++ 2Ag ==Tl+ + 2Ag+。下列推断正确的是
A.Tl+ 的最外层有1个电子 B.Tl3+ 的氧化性比Al3+弱
C.Tl能形成+3价和+1的化合物 D.Tl+ 的还原性比Ag强
4.欲同时对农作物施用含N、P、K三种元素的化肥,现有
①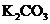 ②KCl ③
②KCl ③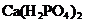 ④
④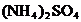 ⑤氨水,最适合的组合是
⑤氨水,最适合的组合是
A.①③④ B.②③④ C.①③⑤ D.②③⑤
5.下列有关环境保护的说法中错误的是
A.含氮、磷化合物的生活污水大量排放可使水体富营养化
B.各国工业大量排放二氧化硫是全球气候变暖的主要原因
C.劣质装修材料中的甲醛、苯、氡气等对人体有害
D.废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染
6.设NA表示阿伏加德罗常数。下列叙述正确的是
A.标准状况下,2.24 LS O3中含有0. 1 NA个硫原子
B.0.1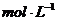 稀硫酸中含有硫酸根个数为0.1
稀硫酸中含有硫酸根个数为0.1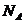
C.1 mol Cu与足量的S反应,转移的电子数为2NA
D.室温下,
7.与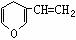 互为同分异构体的芳香族化合物有
互为同分异构体的芳香族化合物有
A.2种 B.3种 C.4种 D.5种
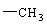
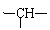
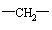 8、某有机物链状分子中含n个 , m个 , a个 , 其余为羟基。则该有机物分子中羟基的个数为
8、某有机物链状分子中含n个 , m个 , a个 , 其余为羟基。则该有机物分子中羟基的个数为
A、2n+
9.下列分子中所有原子不可能同时存在于同一平面上的是
A.CH2=CH
―CH=CH2 B.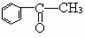
C.ClCH=CHCHO D.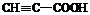
10.2008 年北京奥运会主体育场的外形好似“鸟巢” ( The Bird Nest )。有一类硼烷也好似鸟巢,故称为巢式硼烷。巢式硼烷除 B10H14不与水反应外,其余均易与水反应生成氢气和硼酸,硼烷易被氧化。下图是三种巢式硼烷,有关说法正确的是
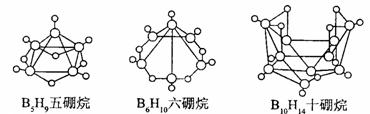
A.这类巢式硼烷的通式是 B nH n + 4
B.2B5H9 + 12O2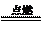 5B2O3
十9H2O
,l molB5H9完全燃烧转移25mol电子
5B2O3
十9H2O
,l molB5H9完全燃烧转移25mol电子
C.8 个硼原子的巢式硼烷化学式应为 B8H10
D.硼烷与水反应是非氧化还原反应
11.下列各组离子在指定条件下,一定能大量共存的是
A.能使紫色石蕊试液显红色的溶液:K+、I-、SO42―、NO3―、Cl―
B.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2―、Br―
C.水电离出的c(H+)=10―12mol/L的溶液:Ba2+、Na+、NO3―、Cl―
D.加入铝条有氢气放出的溶液:Na+、NH4+、HCO3―、NO3―
12.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的摩尔体积比乙的摩尔体积小
B.甲的物质的量比乙的物质的量少
C.甲的分子数比乙的分子数多
D.甲的相对分子质量比乙的相对分子质量小
13..常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO B.(NH4)2SO4 K2SO4 NH4Cl
C.AgNO3 KNO3 Na2CO3 D.Na2CO3 NaHCO3 K2CO3
14.下列反应的离子方程式书写正确的是
A.铝与氢氧化钠溶液反应:2Al+2OH―==2Al O2― +H2↑
B.漂白粉溶液中通入适量的SO2
Ca2++2ClO--+SO2+H2O = CaSO3↓+2HClO
C.石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3
D.Ca(HCO3)2与过量Ca(OH)2溶液反应: Ca2++HCO3-+OH-=CaCO3↓+H2O
15.可用右图装置制取(必要时可加热、尾气处理已省略)、净化、收集的气体是
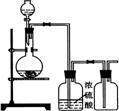 A.铜和稀硝酸制一氧化氮
A.铜和稀硝酸制一氧化氮
B.二氧化锰与浓盐酸制氯气
C.锌和稀硫酸制氢气
D.用生石灰和浓氨水制氨气
16.单质X都能从盐的溶液中置换出单质Y,由此可知
A.当X、Y都是金属时,X一定比Y活泼
B.当X、Y都是非金属时,Y一定比X活泼
C.当X是金属时,Y不可能是非金属
D.当X是非金属时,Y可能是金属,也可能是非金属
17.与羟基具有相同质子数和电子数的微粒是
A.OH― B.N C.―NH2 D.CH3+
18.将
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
19.有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol?L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
20.浅绿色的Fe(NO3)2溶液中存在平衡:Fe2++2H2O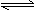 Fe(OH)2+2H+,若向溶液中加入稀盐酸,则溶液的颜色
Fe(OH)2+2H+,若向溶液中加入稀盐酸,则溶液的颜色
A.绿色变浅 B.绿色变深 C.变黄 D.不变
21.NaHCO3和Na2CO3?10H2O晶体的混合物
A、
22.已知1―18号元素的离子aX2+、bY2-、cZ-、dW+都具有相同的电子层结构,下列关系正确的是
A. 离子半径X2+〉Y2- B.离子的还原性Y2-<Z-
C.氢化物的稳定性H2Y>HZ D.原子半径X<W
23.已知气体的摩尔质量越小,扩散速度越快。右图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是
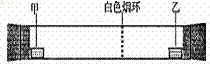 A.甲是浓氨水,乙是浓硫酸
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水
24.已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的
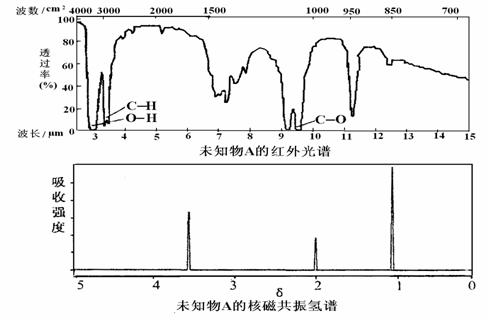
A.由红光外谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知该有机物的化学式
D.若A的化学式为C2H6O,则其结构简式为CH3―O―CH3
25.在由Fe、FeO、Fe2O3组成的混合物中加入100mL2mol/L盐酸,恰好使混合物完全溶解,放出448mL(标准状况)气体,此时溶液中无Fe3+。下列判断正确的是
A、混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3
B、反应后所得溶液中的Fe2+和Cl-的物质的量之比为1:2
C、混合物中Fe、FeO、Fe2O3的物质的量之比无法确定,但Fe比Fe2O3的物质的量少
D、混合物中,Fe2O3的物质的量无法确定,但Fe一定比FeO的物质的量多
二、填空题
26.W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为____________________________________。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为__________ ____。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因 _ _________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z最高价氧化物对应的水化物的酸性__________>___________(用分子式表示)
27.(6分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+ 、AlO2-、SO42-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。则原溶液中肯定存在的离子是_____________,肯定不存在的离子是________________
已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀
28、茚是一种碳氢化合物,其结构为:  茚一种同分异构体A,A分子中含有一个苯环,且苯环上只有一个侧链,侧链中有一个碳碳不饱和键。A能发生如下变化:
茚一种同分异构体A,A分子中含有一个苯环,且苯环上只有一个侧链,侧链中有一个碳碳不饱和键。A能发生如下变化:

已知: 多个羟基连在同一个碳原子上不稳定,易自动失水:
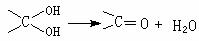
若B、C、D、E分子中均有一个苯环,根据变化关系图和已知条件,请回答
⑴ A的结构简式是 B的结构简式是
⑵ 写出下列反应的化学方程式
① E经缩聚生成高聚物
② F经加聚生成高聚物
⑶ E→F的有机反应类型是 反应。
三、实验题
29.Ⅰ.合成氨工业具有重要意义,写出氨的两种重要用途
Ⅱ.实验室制备氨气,下列方法中适宜选用的是
①固态氯化铵加热分解 ②固体氢氧化钠中滴加浓氨水
③氯化铵溶液与氢氧化钠溶液共热 ④固态氯化铵与氢氧化钙混合加热
Ⅲ为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)
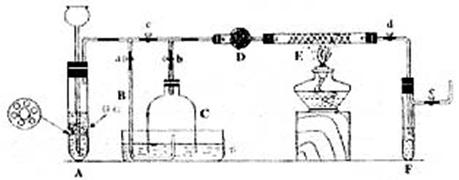
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e,在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生,在F出口处收集氢气并检验其纯度。②关闭弹簧夹c。取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞如图所示。氢气继续在瓶内燃烧,几分钟后火焰息灭。③用酒精灯加热反应管E继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 防止了实验装置中压强过大。此时再打开弹簧夹b的原因是______________ _
C瓶内气体的成分是__________________________
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是 。
四、计算题
30.(10分 )由Cu、Cu2O和CuO组成的混合物,加入100ml0.6mol/L的HNO3溶液恰好使混合物完全溶解,同时收集到224mlNO气体(标况)。回答下列问题:
(1)写出Cu2O跟稀硝酸反应的化学方程式:_____________________________________
(2)产物中硝酸铜的物质的量为__________mol。
(3)如原混合物中有0.01molCu,则其中Cu2O的物质的量为_______mol;CuO的物质的量为_______mol。
(4)如原混合物中Cu的物质的量为x,求x的取值范围_________________。
浙江省台州中学2009届高三上学期期中试题
一、选择题(每小题只有一个正确选项,每题2分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
A
C
C
B
B
D
D
C
B
A
C
B
D
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
D
B
A
C
D
D
C
B
D
C
D
B
二、填空题(共50分)
26、(10分)
①离子方程式为 Al(OH)3+OH-=AlO2-+2H2O ②电子式为 
③显 酸 性;原因 Al3++SH2O Al(OH)3+3H+
Al(OH)3+3H+
④化学方程式为 SO2+Cl2+2H2O=2HCl+H2SO4
⑤稳定性 HCl > H2S
27、(6分)
肯定有的离子 K+、AlO2-、CO32- ;肯定不存在的离子 NH4+、Al3+、SO42-
 是否有Cl- 有
是否有Cl- 有
 28、(10分)
28、(10分)
 (1)A
B
(1)A
B
 |

 (2)化学方程式①
(2)化学方程式①
② ③反应类型是 消去
29、(14分)
I: 制硝酸 制化肥
II: ② ④
Ⅲ:①目的 防止不钝的氢气加热不安全
②现象是 固液脱离接触
原因是 以大氢气的浓度提高N2转化率
气体成分是 N2、H2
③原因是 铁触媒在较高温度时活性大,加快氨合成速率
化学方程式 
四、计算题(共10分)
30、(10分)
 ①
① 
② 0.025
③ 0.005 0.005
④ 0.005mkx<0.015ml
 天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
|
