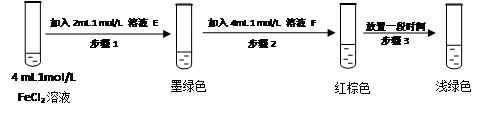网址:http://m.1010jiajiao.com/timu_id_295400[举报]
一、选择题(每小题只有一个正确选项,每题2分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
A
C
C
B
B
D
D
C
B
A
C
B
D
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
D
B
A
C
D
D
C
B
D
C
D
B
二、填空题(共50分)
26、(10分)
①离子方程式为 Al(OH)3+OH-=AlO2-+2H2O ②电子式为 
③显 酸 性;原因 Al3++SH2O Al(OH)3+3H+
Al(OH)3+3H+
④化学方程式为 SO2+Cl2+2H2O=2HCl+H2SO4
⑤稳定性 HCl > H2S
27、(6分)
肯定有的离子 K+、AlO2-、CO32- ;肯定不存在的离子 NH4+、Al3+、SO42-
 是否有Cl- 有
是否有Cl- 有
 28、(10分)
28、(10分)
 (1)A
B
(1)A
B
 |

 (2)化学方程式①
(2)化学方程式①
② ③反应类型是 消去
29、(14分)
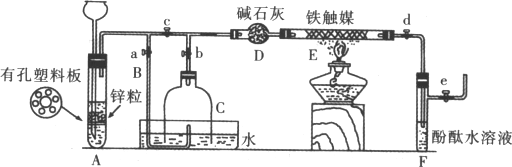
I: 制硝酸 制化肥
II: ② ④
Ⅲ:①目的 防止不钝的氢气加热不安全
②现象是 固液脱离接触
原因是 以大氢气的浓度提高N2转化率
气体成分是 N2、H2
③原因是 铁触媒在较高温度时活性大,加快氨合成速率
化学方程式 
四、计算题(共10分)
30、(10分)
 ①
① 
② 0.025
③ 0.005 0.005
④ 0.005mkx<0.015ml
 天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有
天星教育网(www.tesoon.com) 版权所有

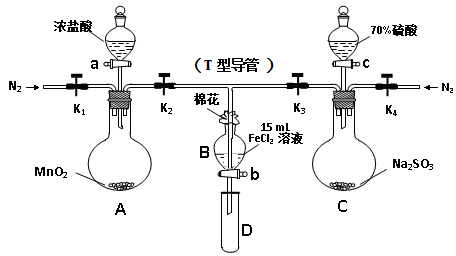
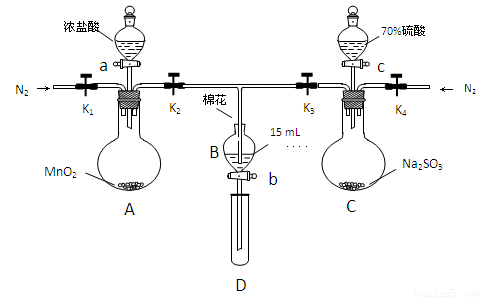
 FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
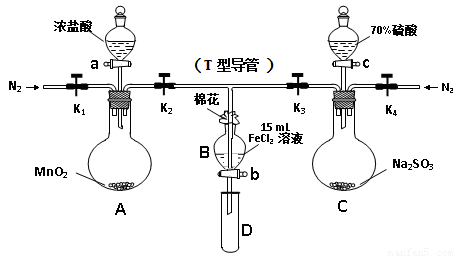
 FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
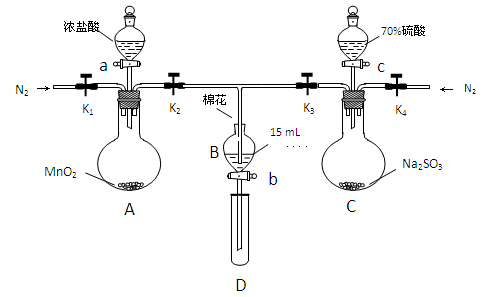
 FeSO3(s)
FeSO3(s)
 FeSO3(s)
FeSO3(s)