2005年重庆市中考化学试卷
可能用到的相对原子质量:
H―
一、我会选择
(本大题16小题,每小题2分,共32分)每小题只有一个正确选项。将正确选项的序号填入括号内。
1. 下列材料属于合成材料的是( )
A. 聚乙烯塑料 B. 陶瓷
C. 硬铝 D. 钢筋混凝土
2. 下列探究实验中,可确认没有发生化学变化的是( )

A. 铝放入硫酸铜溶液 B. 对着干燥玻璃片呼气
C. 镁条燃烧 D. 蜡烛燃烧
3. 通常状况下,闻气味就能区别的一组物质是( )
A. 氢气和氮气 B. 氧气和空气
C. 酒精和醋酸 D. 食盐和味精
4. 环境污染已成为人类社会面临的重大威胁,下列现象与环境污染无关的是( )
A. 潮汐 B. 温室效应 C. 酸雨 D. 臭氧空洞
5. 重庆市某温泉的水质为硬水,下列说法正确的是( )
A. 硬水是一种纯净物
B. 硬水中含较多钙离子和镁离子
C. 硬水放一段时间就变成软水
D. 凡是含有杂质的水就是硬水
6. 为了减少大气污染,重庆地区推广汽车使用压缩天然气(CNG),下列有关天然气的说法中不正确的是( )
A. 天然气的主要成分是氢气
B. 天然气的主要成分是甲烷
C. 天然气是三大化石燃料之一
D. 与煤、柴油相比天然气是清洁能源
7. 下列仪器只需用水就能清洗干净的是( )
A. 久置的装石灰水的试管
B. 附有蔗糖的试管
C. 附有植物油的试管
D. 附有铁锈迹的试管
8. 小明在家庭小实验中把下列物质分别放入适量水中充分搅拌,其中不能得到溶液的是( )
A. 面粉 B. 纯碱 C. 食盐 D. 白酒
9. 下列物质与稀盐酸不能反应的是( )
A. 铝 B. 镁 C. 铜 D. 铁
10. 微量元素是指在人体内总含量不到万分之一的20多种元素,这些元素对人体正常代谢和健康起着重要作用,下列属于微量元素的是( )
A. 氢 B. 钙 C. 碳 D. 氧
11. 下列灭火方法不正确的是( )
A. 扑灭森林火灾,设置隔离带
B. 酒精灯打翻桌上起火,用湿抹灭盖灭
C. 油锅着火,加水扑灭
D. 液化气管道漏气被引燃,先关闭气阀,再灭火
12. 在下列物质的溶液中加入氢氧化钠溶液,能产生蓝色沉淀的是( )

13. 有强腐蚀性的氢氧化钠溶液溅在皮肤上,处理时需要的物质及先后顺序是( )
A. 水 稀盐酸 B. 稀盐酸 水
C. 水 稀醋酸 D. 稀醋酸 水
14.
A. 使用菜篮购物,拒绝一次性塑料袋
B. 大量砍伐森林,提倡使用一次性木筷
C. 使用无磷洗衣粉与无磷洗涤剂
D. 提倡使用无氟冰箱
15. 下列实验一定不需要玻璃棒的是( )
A. 过滤含泥沙的水
B. 用pH试纸测定土壤的pH
C. 稀释浓硫酸
D. 将品红加入水中证明分子运动
16. 生活中处处有化学,在实际生活中下列物质的用途与其化学性质有关的是( )
A. 氦气用于充灌气球 B. 金刚石用于切割玻璃
C. 干冰用于人工降雨 D. 熟石灰用于改良酸性土壤
二、我会填空(本大题8小题,共35分)
17. (7分)写出下列反应的化学方程式:
(1)盐酸与氢氧化钠溶液反应
______________________________________________________
(2)实验室用石灰石与盐酸反应制取二氧化碳气体
______________________________________________________
(3)将锌粒放入稀硫酸中
__________________,反应类型为______________。
18. (3分)(1)同学们喜爱的饮料之一娃哈哈营养快线,其配料有:①纯净水 ②鲜牛奶 ③白砂糖 ④柠檬酸 ⑤食用香精 ⑥维生素E等多种维生素。其中属于无机化合物的是________(填番号,下同),含有蛋白质的是___________,能为人体提供能量的是______________________。
19. (4分)化学肥料可以提供促进农作物生长的营养元素。现有一种常见的化学肥料,由A、B、C、D四种元素组成,其中A元素是氧;B元素形成的气体物质,在空气中所占体积分数约为78%;C元素形成的单质,是所有物质中相对分子质量最小的;D元素可形成一种组成为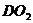 的化合物,在绿色植物的光合作用中扮演重要角色。
的化合物,在绿色植物的光合作用中扮演重要角色。
(1)写出三种元素的元素符号:B___________,C___________,D___________;
(2)该化肥是一种盐,其阴离子只带一个单位的负电荷,试写出该肥料的化学式___________。
20. (4分)今有4组物质:
①氧气、二氧化硫、氢气、氮气
②冰、干冰、氧化铜、金刚石
③纯碱、烧碱、碳酸钙、氯化亚铁
④食醋、牛奶、加碘盐、水
各组中均有一种物质所属类别与另三种不同,请在下面的横线上填写出这种物质的名称:
①___________;②___________;③___________;④___________.
*21. (4分)甲、乙、丙三位同学对构成物质的微粒的性质进行探究,实验如下:
实验学生
实验操作
甲
取两只50mL量筒,分别量取50mL蒸馏水,倒入一个100mL量筒中,滴入几滴红墨水,静置
乙
取两只50mL量筒,分别量取50mL酒精,倒入一个100mL量筒中,滴入几滴红墨水,静置
丙
取两只50mL量筒,分别量取50mL蒸馏水和50mL酒精,倒入一个100mL量筒中,滴入几滴红墨水,静置
静置一段时间后,甲、乙、丙三位同学观察到相同的实验现象,这种现象是___________
_________________________________,你对此现象的解释是______________________。丙同学观察到混合后的体积比混合前的总体积___________,对此,你的解释是___________
_________________________________。
*22. (4分)A、B、C、D四个烧杯分别盛有
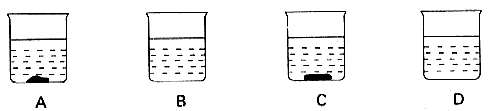
(1)___________中盛有的一定是不饱和溶液。
(2)保持温度不变,如果将A、B烧杯中的物质混合后,溶液刚好达到饱和,则该物质的饱和溶液中溶质的质量分数是___________。
*23. (4分)中央电视台每周质量监测报告揭露了这样一个事件,不法奸商为使腌肉制品的色泽更吸引顾客,用超量的亚硝酸钠(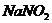 )腌制,亚硝酸钠是一种潜在的致癌物质,过量或长期食用会对人体产生危害。由于亚硝酸钠有咸味,外观与氯化钠相似,曾多次发生过因误食而导致中毒的事件,经过查阅有关资料,我们了解到以下信息:亚硝酸钠的水溶液呈碱性,亚硝酸钠能将
)腌制,亚硝酸钠是一种潜在的致癌物质,过量或长期食用会对人体产生危害。由于亚硝酸钠有咸味,外观与氯化钠相似,曾多次发生过因误食而导致中毒的事件,经过查阅有关资料,我们了解到以下信息:亚硝酸钠的水溶液呈碱性,亚硝酸钠能将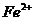 转化为
转化为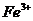 ,请回答以下问题:
,请回答以下问题:
(1)亚硝酸钠(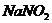 )所属类别是__________(选填:单质、氧化物、酸、碱、盐),其中氮元素化合价为_________;
)所属类别是__________(选填:单质、氧化物、酸、碱、盐),其中氮元素化合价为_________;
(2)下列方法中,能用来区别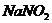 与
与 固体的是_________;
固体的是_________;
A. 观察颜色 B. 品尝味道
C. 用水溶解 D. 分别溶于水测其pH
(3)人体正常的血红蛋白中含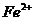 ,若误食亚硝酸钠,就会导致血红蛋白中毒(失去运输氧的功能),服用维生素C可以解毒,下列叙述不正确的是_________。
,若误食亚硝酸钠,就会导致血红蛋白中毒(失去运输氧的功能),服用维生素C可以解毒,下列叙述不正确的是_________。
A. 亚硝酸钠腌肉时发生了化学反应
B. 维生素C主要存在于蔬菜与水果中
C. 维生素C可将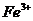 转化成
转化成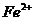
D. 亚硝酸钠可代替食盐作调味剂
*24. (5分)在一密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应,测得反应前后各物质的质量如下:
物质
氧气
二氧化碳
水蒸气
M
反应前质量/g
100
1
1
46
反应后质量/g
4
89
55
x
(1)根据质量守恒定律,你认为x的值应为_________;
(2)未知物质M一定含有的元素为_________;
(3)已知未知物质M的相对分子质量为46,推出其化学式为_________;
(4)该反应的化学方程式为_____________________________________________。
三、我会实验(本大题4小题,共25分)
25. (4分)现有仪器①集气瓶 ②铁架台 ③量筒 ④烧杯。请在下列空格中填上所需仪器的序号。
(1)用于量度液体体积_____________________________________________;
(2)用于收集或贮存少量气体_____________________________________________;
(3)用于配制溶液或者作较大量试剂反应的容器___________________________;
(4)用于固定和支持各种仪器_____________________________________________。
26. (4分)依依同学家里有一段已经裸露出红色金属的废电话线,现在请和依依一起进行探究:
(1)该金属可能是_________(填名称);
(2)依依同学取出金属导线置于火焰上灼烧,现象是___________________________,反应的化学方程式为____________________________________;
(3)再将灼烧后的导线放入白醋(无色)中,反复以上两个操作,溶液可能会变成_________色。
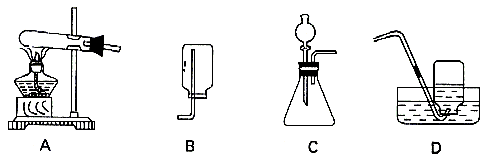
27. (4分)实验室用高锰酸钾制取氧气,请在下列装置中选择填空:实验室制氧气的装置为_________(填番号,下同),选择该装置的理由是___________________________;收集氧气的装置为_____________________________________________,选择该装置的理由是_____________________________________________。
*28. (13分)重庆市珞璜电厂是一个大型的火力发电厂,某研究性学习小组经过调查了解到厂里燃烧煤后的废气中含有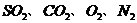 等,他们收集了一些经除尘后的废气样品,对其中的二氧化硫与二氧化碳进行检验。探究过程如下,请回答其中的相关问题:
等,他们收集了一些经除尘后的废气样品,对其中的二氧化硫与二氧化碳进行检验。探究过程如下,请回答其中的相关问题:
[查阅资料]二氧化硫的部分性质:二氧化硫是一种无色、有刺激性气味的有毒气体,易溶于水,密度比空气大;能与水反应生成亚硫酸(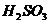 ),能与石灰水反应生成白色的亚硫酸钙(
),能与石灰水反应生成白色的亚硫酸钙(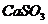 )沉淀,反应的化学方程式为:
)沉淀,反应的化学方程式为: ,能与紫色高锰酸钾溶液反应并使其褪色。
,能与紫色高锰酸钾溶液反应并使其褪色。
二氧化硫与二氧化碳相似的化学性质有___________________________。
[实验]实验装置如下(高锰酸钾溶液中加有硫酸,有利于观察现象):
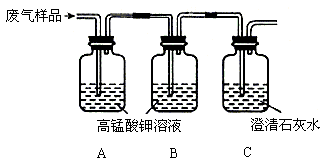
请帮他们完成下表:
操作步骤
简答
①将各装置按上图连接并装入化学试剂
A装置的作用是_______________________;
B装置的作用是_______________________。
②往A的导管口缓缓连续鼓入经除尘后的废气样品
A装置中的现象是____________________;
C装置中的现象是____________________。
[结论与讨论]通过上述探究实验,该小组获得了检验混合气体中二氧化硫与二氧化碳的方法,该方法是:____________________________________________________________
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
[应用]已知
四、我会计算(本大题共8分)
29. (3分)“苏丹红一号”是一种红色的工业合成染色剂,一般用于溶剂、机油、汽车蜡和鞋油等产品的染色。卫生部于今年4月6日发布苏丹红评估报告指出:经常摄入含较高剂量苏丹红的食品会增加致癌的危险性,在食品中应禁用。“苏丹红一号”化学式为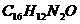 ,回答下列问题:
,回答下列问题:
(1)“苏丹红一号”分子中的原子个数为__________;
(2)“苏丹红一号”中碳、氢、氮、氧元素的质量比为__________;
(3)“苏丹红一号”中氮元素的质量分数为__________。
*30. (5分)洪涝灾害地区的人们常用两种化学物质处理河水,一种是明矾,用于吸附水中悬浮杂质使其沉降,另一种是漂白粉,用于杀菌消毒。漂白粉的主要成分是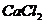 与
与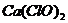 ,它是由化工厂用氯气与熟石灰作原料制得的,化学方程式为
,它是由化工厂用氯气与熟石灰作原料制得的,化学方程式为
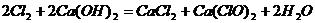 ,假如现有主要成分占80%的漂白粉
,假如现有主要成分占80%的漂白粉
(1)漂白粉中主要成分的质量为多少?
(2)欲制得
(3)自来水厂现已推广使用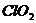 代替漂白粉,推测
代替漂白粉,推测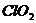 中起杀菌消毒作用的元素是(填名称)__________。
中起杀菌消毒作用的元素是(填名称)__________。
一、我会选择
1. A 2. B 3. C 4. A 5. B 6. A
7. B 8. A 9. C 10. B 11. C 12. D
13. C 14. B 15. D 16. D
二、我会填空
17. (1)
(2)
(3) 置换反应
置换反应
18. ① ② ②③
19. (1)N
H C (2)
20. ①二氧化硫 ②金刚石 ③烧碱 ④水
21. 红色在液体中慢慢扩散
构成红墨水的微粒不停运动,扩散到液体中 小
构成物质的微粒间有间隔
*22. (1)B (2)26.5%
*23. (1)盐 +3 (2)D (3)D
*24. (1)0 (2)C、H、O (3)
(4)
三、我会实验
25. (1)③ (2)① (3)④ (4)②
26. (1)铜
(2)金属表面由红色变成黑色 
(3)蓝
27. A 反应物为固体,需加热 D 氧气不易溶于水
*28. [查阅资料]:能与水反应;能与 反应
反应
[实验]:
A:检验二氧化硫气体,吸收二氧化硫将其除去,消除对二氧化碳检验的干扰;
B:检验二氧化硫是否除尽。
A:溶液紫色褪去(或溶液褪色,或颜色变浅);
C:澄清的石灰水变浑浊。
[结论与讨论]:将混合气体先通过高锰酸钾溶液检验并吸收二氧化硫气体;再通过高锰酸钾溶液检验二氧化硫气体是否被除尽,最后将气体导入澄清石灰水中检验二氧化碳气体的存在。
[应用]:熟石灰的悬浊液 熟石灰与高锰酸钾相比成本较低,熟石灰的悬浊液比澄清的石灰水含溶质多,吸收效率高。
四、我会计算
29. (1)31 (2)192:12:28:16 (3)11.3%
*30. (1)解:漂白粉中主要成分的质量:
(2)解:设所需 的质量为x
的质量为x

(3)氯
答:略