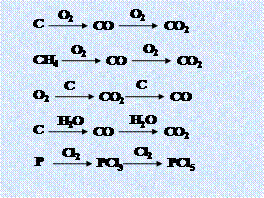
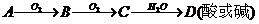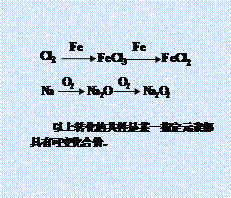无机框图解题规律总结

一、 依据特殊的物理性质:
1.常见的有颜色的物质:
固体 淡黄色或黄色:S 黄、FeS2 黄、Na2O2 浅黄、AgBr 浅黄、
AgI 黄、Au 黄、CuFeS2 黄、TNT 淡黄等。
红色或红棕色:Cu 紫红、 Cu2O 红、Fe2O3 红棕等。
黑色:C(金刚石)无色、C(石墨)黑、CuS、Cu2S 黑、FeS 黑、MnO2黑、
FeO黑、 Fe3O4(磁性物质)黑色晶体、CuO 黑、PbS 黑、Ag2O 棕黑等。
紫黑色:I2 紫黑、KMnO4 紫黑
白色腊状固体:白磷
溶液 Cu2+蓝、 MnO4- 紫红、Fe2+ 浅绿、Fe3+ 棕黄、Fe(SCN)3 血红、NO2- 浅黄、[CuCl4]2- 黄、
[Cu(H2O)4]2+蓝。
氯水浅黄绿色、 溴水橙黄色、 碘水棕黄色
溴的有机溶液 橙红―红棕、 I2的有机溶液 紫红
气体 Cl2 黄绿、NO2 棕红、 Br2 蒸气红棕、I2 蒸气紫色、N2O3 暗蓝
2.物质的状态、气味硬度等:
呈液态的金属单质:Hg 呈液态的非金属单质:Br2
常温呈气态的单质:H2、O2、Cl2、N2、F2、稀有气体等。
臭鸡蛋气味的气体:H2S
刺激性气味的气体:Cl2 SO2 HCl NH3
地壳中元素的含量:O Si Al Fe
硬度最大的单质:C(金刚石)
形成化合物种类最多的元素: C
3.依据焰色反应判断元素:
Na 黄、 K 浅紫(通过蓝色钴玻璃)、Cu 绿、
Li 紫红、 Rb 紫、Ca 砖红、 Ba 黄绿、 Rb 紫、Sr 洋红。
(1)遇酚酞显红色或湿润红色石蕊试纸变蓝的气体:NH3(碱性气体)
(2)遇空气变为红棕色的气体:NO
(3)加碱产生白色沉淀,迅速变成灰绿色,最终变成红褐色,必有Fe2+
(4)加苯酚显紫色或加SCN-显血红色或加碱产生红褐色沉淀,必有Fe3+
(5)遇BaCl2生成不溶于硝酸的白色沉淀,可能是:SO42―、Ag+、 SO32―
(6)遇HCl生成沉淀,可能是: Ag+、 SiO32―、AlO2―、S2O32―
(7)遇H2SO4生成沉淀,可能是:Ba2+、Ca2+、S2O32―、SiO32―、AlO2―
(8)与H2S反应生成淡黄色沉淀的气体有Cl2、O2、SO2、NO2
(9)电解时阳极产生的气体一般是:Cl2、O2,阴极产生的气体是:H2
(10)能使品红溶液褪色的气体可能是:Cl2、SO2;加热恢复原颜色的是SO2,不恢复的是Cl2
能使品红溶液褪色的物质可能有:NaClO、Ca(ClO)2等次氯酸盐、氯水、过氧化钠、过氧化氢、活性碳等
(11) 遇淀粉变蓝的:碘单质
(12)遇到淀粉碘化钾试纸变蓝的气体有:Cl2、 NO2、 Br2蒸气、I2蒸气
三、 特殊的反应条件和特征反应:
1.与碱反应产生气体
(1)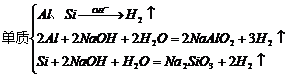
(2)铵盐: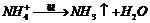
2.与酸反应产生气体
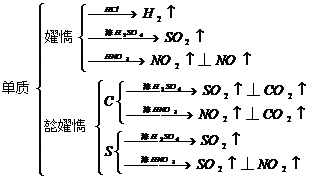 (1)
(1)
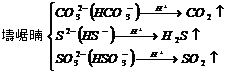 (2)
(2)
3.与水反应产生气体
(1)单质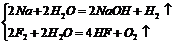
(2)化合物:
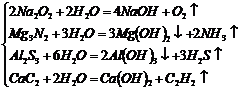
 |
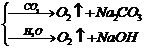 4.与Na2O2反应
4.与Na2O2反应
5.既能酸反应,又能与碱反应
Al、Al2O3、Al(OH)3、弱酸的酸式盐(NaHCO3、NaHSO3、NaHS等) 、弱酸的氨盐[NH4HCO3、(NH4)2CO3、NH4HSO3、 (NH4)2SO3、 (NH4)2S、NH4HS等]、氨基酸等;
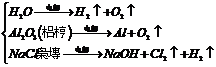 6.电解
6.电解
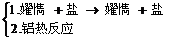
7.置换反应:(1)金属→金属
(2)金属→非金属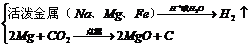
(3)非金属→非金属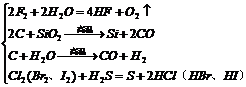
(4)非金属→金属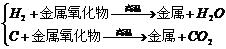
8.受热分解产生2种或3种气体的反应:
(1)铵盐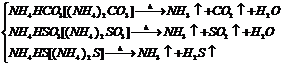
§(2)硝酸盐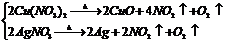
(3)硝酸:4HNO3=====2H2O+4NO2↑+O2↑
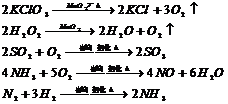 (4)碱式碳酸铜:Cu(OH)2(CO3)2 ====== CuO + 2CO2↑ + H2O
(4)碱式碳酸铜:Cu(OH)2(CO3)2 ====== CuO + 2CO2↑ + H2O
9.无机框图中常用到催化剂的反应:
10.同一元素的气态氢化物和气态氧化物反应,生成该元素的单质和水的元素可能是硫和氮
2H2S+SO2=3S+2H2O
4NH3+6NO 4N2+6H2O
4N2+6H2O
同一元素的气态氢化物和最高价氧化物对应的水化物生成盐的元素一定是氮
11.两种溶液混合生成沉淀和气体,这两种溶液的溶质可能是
①Ba(OH)2与(NH4)2SO4或(NH4)2CO3或(NH4)2SO3
②可溶性铝盐与可溶性金属硫化物或可溶性碳酸盐或碳酸氢盐
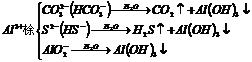
强烈双水解
③可溶性铁盐与可溶性碳酸盐或碳酸氢盐
④Na2S2O3溶液与强酸
13.能使溴水褪色的物质:H2S和SO2及它们相对应的盐、活泼金属、不饱和烃、醛、酚、碱
14.两物质反应先沉淀后溶解的有:
CO2与Ca(OH)2或Ba(OH)2、NaOH与铝盐、氨水与AgNO3、强酸与偏铝酸盐
四、 依据特征结构:
1. 正四面体型分子:CH4 SiH4 CCl4 SiCl4 P4等。
2. 直线型分子:乙炔、二氧化碳、二硫化碳等。
3. 平面型分子: 苯、乙烯等。
4. 含有非极性共价键的离子化合物:过氧化钠(Na2O2)、二硫化亚铁(FeS2)等。
5. 含有10个电子的粒子:
离子:O2― F― Ne Na+ Mg2+ Al3+
分子:CH4 NH3 H2O HF NH4+ H3O+ OH- NH2―
6. 电子总数为18的粒子:
(9个电子的粒子:―OH ―CH3 ―NH2 ―F)
分子:Ar、F2、SiH4、PH3、H2S、HCl、H2O2、C2H6、CH3OH、CH3NH2、
CH
离子:K+、Ca2+、HS―、S2―、Cl―、O22―
|
 1.X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,试根据下图所示的关系,推断X、Y、Z的化学式。(请尽可能寻找出你认为合理的解答)
1.X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,试根据下图所示的关系,推断X、Y、Z的化学式。(请尽可能寻找出你认为合理的解答)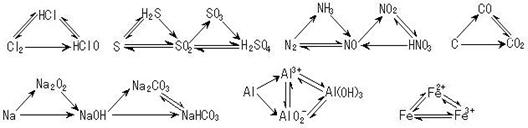 2.三角转化:
2.三角转化: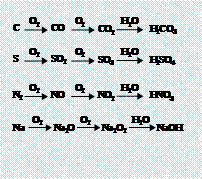 3.直线型关系:(1)
3.直线型关系:(1)