摘要:(4)非金属→金属
网址:http://m.1010jiajiao.com/timu_id_233335[举报]
非金属单质A,经如下图所示的过程转化为含氧酸D,已知D为常见强酸

请回答下列问题:(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体①D的化学式是
②在工业生产中B气体的大量排放被雨水吸收后形成了
(2)若A在常温下为气体,C是红棕色气体
①A和C的化学式分别是:A
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
查看习题详情和答案>>

请回答下列问题:(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体①D的化学式是
H2SO4
H2SO4
②在工业生产中B气体的大量排放被雨水吸收后形成了
酸雨
酸雨
而污染了环境(2)若A在常温下为气体,C是红棕色气体
①A和C的化学式分别是:A
N2
N2
CNO2
NO2
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
.非金属单质A经下图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
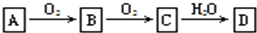
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体.
①D的化学式是
②在工业生产中,大量排放的B气体被雨水吸收后形成了
(2)若A在常温下为气体,C是红棕色气体.
①A、C的化学式分别是:A
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
查看习题详情和答案>>
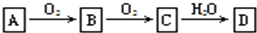
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体.
①D的化学式是
H2SO4
H2SO4
;②在工业生产中,大量排放的B气体被雨水吸收后形成了
酸雨
酸雨
而污染环境.(2)若A在常温下为气体,C是红棕色气体.
①A、C的化学式分别是:A
N2
N2
;CNO2
NO2
.②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
.该反应属于
属于
(填“属于”或“不属于”)氧化还原反应.非金属元素氮有多种氧化物,如NO、NO2、N2O4等.已知 N2O4 和NO2相互转化关系为:N2O4(g)?2NO2(g)△H=+57kJ?mol-1
(1)在100℃时,将0.400mol的NO2气体充入2L抽空的恒容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为
②若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是
③计算②中条件下达到平衡后混合气体的平均相对分子质量为
④某温度时测得该反应的平衡常数K的值为0.28,则该温度
(2)①实验室制取NO2时,用
②要测定NO2的相对分子质量时,选择的实验条件是:
查看习题详情和答案>>
(1)在100℃时,将0.400mol的NO2气体充入2L抽空的恒容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
0.0025mol?(L?s)-1
0.0025mol?(L?s)-1
.②若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是
0.10
0.10
mol?L-1.③计算②中条件下达到平衡后混合气体的平均相对分子质量为
57.5
57.5
.(结果保留小数点后一位)④某温度时测得该反应的平衡常数K的值为0.28,则该温度
<
<
100℃(填“>”、“<”或“=”).升高温度后,反应2NO2?N2O4的平衡常数K将减小
减小
(填“增大”、“减小”或“不变”).(2)①实验室制取NO2时,用
向上排气
向上排气
法收集;②要测定NO2的相对分子质量时,选择的实验条件是:
高温低压
高温低压
(温度高低、压强大小角度考虑).