江苏省如皋市2009届高三第一次统一考试
化 学 试 卷(选修)
可能用到的相对原子质量:H-
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.下列有关环境问题的说法正确的是
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
2.下列叙述正确的是

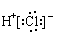 A.聚丙烯的结构简式为:
A.聚丙烯的结构简式为:
B.HCl的电子式为:
 C.NH3的结构式为:
C.NH3的结构式为:
D.Ar原子的结构示意图为:
3.将
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.向溶液中滴入无色的KSCN溶液,显血红色
C.Fe2+和Fe3+的物质的量之比为5∶1
D.氧化产物与还原产物的物质的量之比为2∶5
 4.1831年英国化学家Graham通过实验发现:在同温同压下,不同气体的扩散速率(v)与气体的摩尔质量(M)的平方根成反比: =
4.1831年英国化学家Graham通过实验发现:在同温同压下,不同气体的扩散速率(v)与气体的摩尔质量(M)的平方根成反比: = 。右图玻璃管(有刻度)中A处棉球沾有浓氨水,C处棉球沾有浓盐酸,则最先有白烟生成的地方约在
。右图玻璃管(有刻度)中A处棉球沾有浓氨水,C处棉球沾有浓盐酸,则最先有白烟生成的地方约在
A.3刻度处 B.4刻度处 C.5刻度处 D.6刻度处
5.下列离子方程式书写正确的是
A.过量的SO2通人NaOH溶液中:SO2+2OH-=SO32-+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:
2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:
2HCO32-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
6.已知在酸性条件下有以下反应关系:
①KBrO3能将I-氧化成KIO3,本身被还原为Br2;
②Br2能将I-氧化为I2;
③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,本身被还原为I2。
向KBrO3溶液中滴加少量KI的硫酸溶液后,所得产物除水外还有
A.Br-、I2 B.Br2、Br-、I
7.将
A.溶液质量不变 B.溶液浓度不变
C.冷却后溶液仍为饱和溶液 D.冷却后有无水硫酸铜析出
8.将25%的硫酸溶液与5%的硫酸溶液等体积混合,所得硫酸溶液的质量分数是
A.等于15% B.大于15% C.小于15% D.无法估算
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.已知下列反应:
①NH3+H+ NH4+ ②Ag++2NH3
NH4+ ②Ag++2NH3 Ag(NH3)2+ ③Ag++Cl―
Ag(NH3)2+ ③Ag++Cl― AgCl
AgCl
前者都比后者更容易发生。下列事实或现象预期正确的是
A.氯化银可溶于氨水 B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸有白色沉淀 D.银氨溶液可在酸性条件下稳定存在
10.在由水电离产生的H+浓度为1×10-13mol?L-1的溶液中,一定能大量共存的离子组是
A.K+、Fe2+、NO3?、SO42? B.Na+、Cl-、NO3-、SO42-
C.Na+、Ca2+、Cl-、HCO3- D.K+、Ba2+、Cl-、NO3-
11.甲、乙、丙、丁四个烧杯内分别盛放0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁的质量分数大小的顺序是
A.甲<乙<丙<丁 B.丁<甲<乙=丙
C.甲=丁<乙=丙 D.丁<甲<乙<丙
12.将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入足量的一气体X后即有沉淀生成,则X可能是
A.Cl2 B.NH
13.从石英砂制取并获得高纯硅的主要化学反应如下:
① SiO2+ Si(粗)+2CO
Si(粗)+2CO
② Si(粗)+2Cl2 SiCl4
SiCl4
③ SiCl4+2H2 Si(纯)+4HCl
Si(纯)+4HCl
关于上述反应的分析不正确的是
A.①、③是置换反应,②是化合反应
B.高温下,焦炭与氢气的还原性均强于硅
C.任一反应中,每消耗或生成
D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅
14.甲、乙两烧杯中各成盛有50 mL 3 mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为
A.
三、非选择题(共7小题,72分)
15.(10分)某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
实验操作
实验现象
步骤1
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份
有少量气泡产生,溶液的黄绿色褪去
步骤2
将第一份滤液与稀盐酸混合
产生大量气泡
步骤3
将第二份滤液加热
溶液变浑浊,且有大量无色气体产生
⑴ 步骤1中发生反应的离子方程式是______________________________________,过滤的目的是________________________________________________________。
⑵ 步骤2、步骤3的实验目的都是_____________________________,为达到该实验目的,还可以采取的方法是_____________________________________________。
⑶ 请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:_____________________________________________________。
16.(10分)某化学兴趣小组为探索工业废料的再利用,在实验室中用含有铝、铁、铜的合金制取氯化铝溶液、绿矾晶体和胆矾晶体。其实验方案如下:

⑴所加试剂①、②分别是____________________________________。
⑵从滤液E中得到绿矾晶体的实验操作是______________________________________;从滤渣F制取胆矾的第一步操作最好采用_____________________________________。
⑶上述实验方案中,有一步设计明显不合理,请你予以指出,并说明理由__________
_____________________________________________________。你认为正确的设计方案是________________________________________________________________________
______________________________________________________________________。
17.(10分)某实验小组同学在做铜与浓硫酸反应实验时,发现铜片反应结束后,试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有水的烧杯中,发现所得溶液为蓝色,仍然有黑色固体未溶解。
⑴由上述实验可知,原试管底部的白色固体是_____________。
⑵小李同学认为CuO可能不溶于浓硫酸并猜测黑色固体为CuO,小王根据上述实验立即否定了小李的猜测,小王的依据是____________________________________。
⑶为探究黑色固体的组成,小组成员上网检索,获知黑色固体可能是CuS、Cu2S或它们的混合物,同时获知CuS、Cu2S都能被硝酸氧化为Cu2+和SO42-、都能在空气中灼烧生成CuO和SO2。
①写出CuS溶于浓硝酸的化学方程式:_____________________________________。
②将烧杯中黑色固体过滤并洗涤干净,加入少量浓硝酸,待固体溶解后再加入少量BaCl2溶液。该实验过程中,能说明黑色固体中含Cu、S两种元素的实验现象是____________________________________________________________________。
③若你是该实验小组成员,要进一步探究黑色固体到底是CuS、Cu2S还是它们的混合物,应如何设计实验?请简要叙述:___________________________________。
18.(10分)通常情况下空气中CO2的体积分数为0.030%,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
⑴目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作致冷剂已成为一种趋势,这一做法对环境的积极意义在于_______________________________。
 ⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
⑵最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
①分解池中反应的化学方程式为____________________________________________。
②在合成塔中,若有
⑶小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。
小李应该选用的试剂是___________________,实验时测定的数据除空气的体积外,还需要测定____________________________________________________________。
 |
 19.(10分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
19.(10分)下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空:
⑴写出B的电子式:____________________。
⑵反应⑤的现象是_____________________________________________。
⑶反应①的化学反应方程式是________________________________________,
在实验室引发反应④的操作是____________________________________。
⑷反应⑥的离子方程式是_________________________________________。
20.(12分)石油化工是是江苏省的支柱产业之一。丙烯是重要的化工原料,一定条件下可发生下列转化:
 |
回答下列问题:
⑴A的结构简式为____________________。
⑵反应①~⑦中,属于取代反应的是___________________(填序号)。
⑶D与足量乙醇反应生成E的化学方程式为_______________________________。
⑷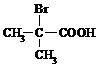 与足量NaOH溶液反应的化学方程式为___________________。
与足量NaOH溶液反应的化学方程式为___________________。
⑸B的同分异构体有多种,其中既能发生银镜反应,又能发生酯化反应的同分异构体的结构简式为:_________________________________________________________
___________________________________________________________________。
21.(10分)将
⑴合金中银的质量分数。
⑵所得气体的组成(若为混合物,需算出各组成成分的体积)。
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.A 2.C 3.B 4.D 5.C 6.D 7.C 8.B
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.AC 10.BD 11.B 12.AB 13.D 14.B
三、非选择题(共7小题,72分)
15.⑴ CaCO3+2H+=Ca2++H2O+CO2↑ 除去碳酸钙等不溶性杂质
⑵ 检验HCO3―离子 另取一份滤液,加入NaOH溶液,观察有无沉淀产生
⑶ 同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢
(每空2分,共10分)
16.⑴NaOH溶液和稀硫酸 ⑵在隔绝空气的条件下,蒸发浓缩、冷却结晶 将滤渣F在空气中灼烧 ⑶由滤液A制得氯化铝溶液不合理,所得氯化铝溶液中含有大量NaCl杂质 向滤液A中通入足量的CO2生成Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解
(每空2分,共10分)
17.⑴CuSO4 ⑵烧杯中有硫酸,黑色固体不溶于硫酸 ⑶①CuS+8HNO3=CuSO4+8NO2↑+4H2O ②所得溶液为蓝色,加BaCl2溶液后有白色沉淀生成 ③将黑色固体在空气中灼烧,比较反应前后固体的质量
(每空2分,共10分)
18.⑴保护臭氧层
⑵①2KHCO3 K2CO3+CO2↑+H2O
K2CO3+CO2↑+H2O
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
⑶Ba(OH)2(或NaOH溶液和BaCl2溶液) 实验时的温度、压强,沉淀的质量
(每空2分,共10分)
19.⑴Na+[ ]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
⑶3Fe+4H2O Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
(每空2分,共10分)
20.⑴CH3CHBrCH3 ⑵②④⑤⑦
⑶ +
+ +2H2O
+2H2O
⑷ +2NaOH
+2NaOH +H2O+NaBr
+H2O+NaBr
⑸HOCH2CH2CH2CHO CH3CH(OH)CH2CHO CH3CH2CH(OH)CHO
(CH3)
(第⑸小题4分,其余每空2分,共12分)
21.⑴参加反应的硝酸的物质的量为(13.5mol/L-1mol/L)×0.080 mol/L=1 mol
被还原的硝酸的物质的量即生成气体的物质的量: =0.3 mol
=0.3 mol
则未被还原的硝酸的物质的量为1mol-0.3mol=0.7 mol
即生成物AgNO3、Cu(NO3)2中含NO3-0.7 mol
设合金中银的质量为x,则: ×1+
×1+ ×2=0.7 mol
×2=0.7 mol
解得:x= =0.36(36%)
=0.36(36%)
(4分)
⑵若生成的0.3 mol气体全部是NO2,则应转移电子0.3 mol
若生成的0.3 mol气体全部是NO,则应转移电子0.9 mol
而合金溶于硝酸时转移电子数为: ×1+
×1+ ×2=0.7 mol
×2=0.7 mol
所以生成的气体中既有NO2,又有NO
根据3n(NO)+n(NO2)=0.7 mol n(NO)+n(NO2)=0.3 mol
算出n(NO)=0.2 mol,n(NO2)=0.1 mol
即V(NO)=
(6分)