网址:http://m.1010jiajiao.com/timu_id_233289[举报]
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.A 2.C 3.B 4.D 5.C 6.D 7.C 8.B
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.AC 10.BD 11.B 12.AB 13.D 14.B
三、非选择题(共7小题,72分)
15.⑴ CaCO3+2H+=Ca2++H2O+CO2↑ 除去碳酸钙等不溶性杂质
⑵ 检验HCO3―离子 另取一份滤液,加入NaOH溶液,观察有无沉淀产生
⑶ 同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢
(每空2分,共10分)
16.⑴NaOH溶液和稀硫酸 ⑵在隔绝空气的条件下,蒸发浓缩、冷却结晶 将滤渣F在空气中灼烧 ⑶由滤液A制得氯化铝溶液不合理,所得氯化铝溶液中含有大量NaCl杂质 向滤液A中通入足量的CO2生成Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解
(每空2分,共10分)
17.⑴CuSO4 ⑵烧杯中有硫酸,黑色固体不溶于硫酸 ⑶①CuS+8HNO3=CuSO4+8NO2↑+4H2O ②所得溶液为蓝色,加BaCl2溶液后有白色沉淀生成 ③将黑色固体在空气中灼烧,比较反应前后固体的质量
(每空2分,共10分)
18.⑴保护臭氧层
⑵①2KHCO3 K2CO3+CO2↑+H2O
K2CO3+CO2↑+H2O
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
⑶Ba(OH)2(或NaOH溶液和BaCl2溶液) 实验时的温度、压强,沉淀的质量
(每空2分,共10分)
19.⑴Na+[ ]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
⑶3Fe+4H2O Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
(每空2分,共10分)
20.⑴CH3CHBrCH3 ⑵②④⑤⑦
⑶ +
+ +2H2O
+2H2O
⑷ +2NaOH
+2NaOH +H2O+NaBr
+H2O+NaBr
⑸HOCH2CH2CH2CHO CH3CH(OH)CH2CHO CH3CH2CH(OH)CHO
(CH3)
(第⑸小题4分,其余每空2分,共12分)
21.⑴参加反应的硝酸的物质的量为(13.5mol/L-1mol/L)×0.080 mol/L=1 mol
被还原的硝酸的物质的量即生成气体的物质的量: =0.3 mol
=0.3 mol
则未被还原的硝酸的物质的量为1mol-0.3mol=0.7 mol
即生成物AgNO3、Cu(NO3)2中含NO3-0.7 mol
设合金中银的质量为x,则: ×1+
×1+ ×2=0.7 mol
×2=0.7 mol
解得:x= =0.36(36%)
=0.36(36%)
(4分)
⑵若生成的0.3 mol气体全部是NO2,则应转移电子0.3 mol
若生成的0.3 mol气体全部是NO,则应转移电子0.9 mol
而合金溶于硝酸时转移电子数为: ×1+
×1+ ×2=0.7 mol
×2=0.7 mol
所以生成的气体中既有NO2,又有NO
根据3n(NO)+n(NO2)=0.7 mol n(NO)+n(NO2)=0.3 mol
算出n(NO)=0.2 mol,n(NO2)=0.1 mol
即V(NO)=
(6分)
| 温度/℃ | FeSO4?7H2O | (NH4)2SO4 | (NH4)2SO4?FeSO4?6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
实验步骤流程图:
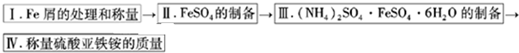
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4?FeSO4?6H2O的质量分数?(列式计算) 查看习题详情和答案>>
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀.溶液由棕黄色变为浅绿色用离子方程式表示为
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如图:
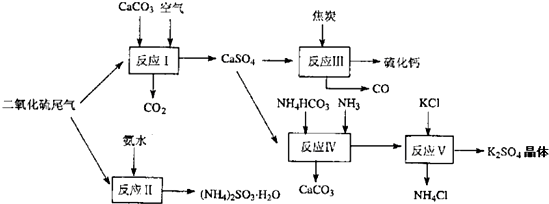
写出反应反应Ⅳ的化学方程式
反应III中氧化剂与还原剂的物质的量之比为
反应V在25'C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如图所示:
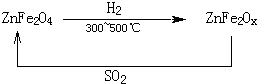
若2molZnFe2Ox与SO2反应可生成 0.75molS,x=
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式
(12分)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式 ;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 。
(2)测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜品体受热可以逐步失去结品水,温度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
在110℃时所得固体的成分为 ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 。(填字母)
A.0 mol B.0.1mol C.0.125mol D.大于0.125mol
查看习题详情和答案>>
(12分)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
(1)工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式 ;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 。
(2)测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜品体受热可以逐步失去结品水,温 度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
度升高还町以分解生成铜的氧化物。观取25.0g CuSO4·5H2O品体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
在110℃时所得固体的成分为 ;在1200℃并恒温1小时,反应所 得气态产物除去水后,物质的量为 。(填字母)
得气态产物除去水后,物质的量为 。(填字母)
| A.0 mol | B.0.1mol | C.0.125mol | D.大于0.125mol |