网址:http://m.1010jiajiao.com/timu_id_233305[举报]
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.A 2.C 3.B 4.D 5.C 6.D 7.C 8.B
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.AC 10.BD 11.B 12.AB 13.D 14.B
三、非选择题(共7小题,72分)
15.⑴ CaCO3+2H+=Ca2++H2O+CO2↑ 除去碳酸钙等不溶性杂质
⑵ 检验HCO3―离子 另取一份滤液,加入NaOH溶液,观察有无沉淀产生
⑶ 同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢
(每空2分,共10分)
16.⑴NaOH溶液和稀硫酸 ⑵在隔绝空气的条件下,蒸发浓缩、冷却结晶 将滤渣F在空气中灼烧 ⑶由滤液A制得氯化铝溶液不合理,所得氯化铝溶液中含有大量NaCl杂质 向滤液A中通入足量的CO2生成Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解
(每空2分,共10分)
17.⑴CuSO4 ⑵烧杯中有硫酸,黑色固体不溶于硫酸 ⑶①CuS+8HNO3=CuSO4+8NO2↑+4H2O ②所得溶液为蓝色,加BaCl2溶液后有白色沉淀生成 ③将黑色固体在空气中灼烧,比较反应前后固体的质量
(每空2分,共10分)
18.⑴保护臭氧层
⑵①2KHCO3 K2CO3+CO2↑+H2O
K2CO3+CO2↑+H2O
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
⑶Ba(OH)2(或NaOH溶液和BaCl2溶液) 实验时的温度、压强,沉淀的质量
(每空2分,共10分)
19.⑴Na+[ ]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
⑶3Fe+4H2O Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
(每空2分,共10分)
20.⑴CH3CHBrCH3 ⑵②④⑤⑦
⑶ +
+ +2H2O
+2H2O
⑷ +2NaOH
+2NaOH +H2O+NaBr
+H2O+NaBr
⑸HOCH2CH2CH2CHO CH3CH(OH)CH2CHO CH3CH2CH(OH)CHO
(CH3)
(第⑸小题4分,其余每空2分,共12分)
21.⑴参加反应的硝酸的物质的量为(13.5mol/L-1mol/L)×0.080 mol/L=1 mol
被还原的硝酸的物质的量即生成气体的物质的量: =0.3 mol
=0.3 mol
则未被还原的硝酸的物质的量为1mol-0.3mol=0.7 mol
即生成物AgNO3、Cu(NO3)2中含NO3-0.7 mol
设合金中银的质量为x,则: ×1+
×1+ ×2=0.7 mol
×2=0.7 mol
解得:x= =0.36(36%)
=0.36(36%)
(4分)
⑵若生成的0.3 mol气体全部是NO2,则应转移电子0.3 mol
若生成的0.3 mol气体全部是NO,则应转移电子0.9 mol
而合金溶于硝酸时转移电子数为: ×1+
×1+ ×2=0.7 mol
×2=0.7 mol
所以生成的气体中既有NO2,又有NO
根据3n(NO)+n(NO2)=0.7 mol n(NO)+n(NO2)=0.3 mol
算出n(NO)=0.2 mol,n(NO2)=0.1 mol
即V(NO)=
(6分)
某实验小组同学在做铜与浓硫酸反应实验时,发现铜片反应结束后,试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有水的烧杯中,发现所得溶液为蓝色,仍然有黑色固体未溶解。
(1)由上述实验可知,原试管底部的白色固体是_____________。
(2)小李同学认为CuO可能不溶于浓硫酸并猜测黑色固体为CuO,小王根据上述实验立即否定了小李的猜测,小王的依据是____________________________________。
(3)为探究黑色固体的组成,小组成员上网检索,获知黑色固体可能是CuS、Cu2S或它们的混合物,同时获知CuS、Cu2S都能被硝酸氧化为Cu2+和SO42-、都能在空气中灼烧生成CuO和SO2。
①写出CuS溶于浓硝酸的化学方程式:_____________________________________。
②将烧杯中黑色固体过滤并洗涤干净,加入少量浓硝酸,待固体溶解后再加入少量BaCl2溶液。该实验过程中,能说明黑色固体中含Cu、S两种元素的实验现象是_________________。
③若你是该实验小组成员,要进一步探究黑色固体到底是CuS、Cu2S还是它们的混合物,应如何设计实验?请简要叙述:___________________________________。
查看习题详情和答案>>(1)由上述实验可知,原试管底部的白色固体是
(2)小李同学认为CuO可能不溶于浓硫酸并猜测黑色固体为CuO,小王根据上述实验立即否定了小李的猜测,小王的依据是
(3)为探究黑色固体的组成,小组成员上网检查后获知黑色固体可能是CuS、Cu2S或它们的混合物,同时获知CuS、Cu2S分别都能被浓硝酸氧化为Cu2+和
| SO | 2- 4 |
①写出CuS溶于足量浓硝酸的化学方程式:
②将烧杯中黑色固体过滤并洗涤干净,加入浓硝酸,待固体溶解后再加入少量BaCl2溶液.该实验过程中,能说明黑色固体中含Cu、S两种元素的实验现象是
③若你是该实验小组成员,要进一步探究黑色固体到底是CuS、Cu2S还是它们的混合手,应如何设计实验?请简要叙述:
某实验小组的同学在做铜与浓硫酸反应的实验时,发现反应结束后,试管底部有白色固体并夹杂有少量黑色物质.倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有水的烧杯中,发现所得溶液为蓝色,同时仍有黑色固体.
(1)由上述实验可知,原试管底部的白色固体是______.
(2)小李同学认为CuO可能不溶于浓硫酸并猜测黑色固体为CuO,小王根据上述实验立即否定了小李的猜测,小王的依据是______.
(3)为探究黑色固体的组成,小组成员上网检查后获知黑色固体可能是CuS、Cu2S或它们的混合物,同时获知CuS、Cu2S分别都能被浓硝酸氧化为Cu2+和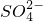 、CuS、Cu2S分别都能在空气中灼烧生成CuO和SO2.
、CuS、Cu2S分别都能在空气中灼烧生成CuO和SO2.
①写出CuS溶于足量浓硝酸的化学方程式:______.
②将烧杯中黑色固体过滤并洗涤干净,加入浓硝酸,待固体溶解后再加入少量BaCl2溶液.该实验过程中,能说明黑色固体中含Cu、S两种元素的实验现象是______.
③若你是该实验小组成员,要进一步探究黑色固体到底是CuS、Cu2S还是它们的混合手,应如何设计实验?请简要叙述:______.
查看习题详情和答案>>
(1)由上述实验可知,原试管底部的白色固体是______.
(2)小李同学认为CuO可能不溶于浓硫酸并猜测黑色固体为CuO,小王根据上述实验立即否定了小李的猜测,小王的依据是______.
(3)为探究黑色固体的组成,小组成员上网检查后获知黑色固体可能是CuS、Cu2S或它们的混合物,同时获知CuS、Cu2S分别都能被浓硝酸氧化为Cu2+和
| SO | 2-4 |
①写出CuS溶于足量浓硝酸的化学方程式:______.
②将烧杯中黑色固体过滤并洗涤干净,加入浓硝酸,待固体溶解后再加入少量BaCl2溶液.该实验过程中,能说明黑色固体中含Cu、S两种元素的实验现象是______.
③若你是该实验小组成员,要进一步探究黑色固体到底是CuS、Cu2S还是它们的混合手,应如何设计实验?请简要叙述:______.
实验一是用纯度、质量、表面积都相同的两铝片与氢离子浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快.
实验二是用相同浓度的稀盐酸与两块铝片(一片是纯铝,另一是含有杂质的铝,含的杂质以铜为主)发生反应时,发现盐酸与含杂质的铝反应产生氢气的速率比纯铝反应更快.他决定对其原因进行探究.请填写下列空白:
对于实验一:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:
原因Ⅲ:Cl-对反应具有促进作用,而SO2-4对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-都对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:
(2)该同学设计进行了两组实验,即得出了正确的结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有体积相同、H+浓度相同的稀硫酸和盐酸的试管(两试管的规格相同)中;
①在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化.
②在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.
③若观察到实验①中
对于实验二:该同学通过查阅资料知道是因为含杂质的铝与盐酸反应时形成了微小的原电池,使铝片与盐酸反应生成氢气的速率加快.为了验证资料中所说的事实,请帮助该同学设计一个对比实验来验证这一事实.