网址:http://m.1010jiajiao.com/timu_id_233302[举报]
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.A 2.C 3.B 4.D 5.C 6.D 7.C 8.B
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.AC 10.BD 11.B 12.AB 13.D 14.B
三、非选择题(共7小题,72分)
15.⑴ CaCO3+2H+=Ca2++H2O+CO2↑ 除去碳酸钙等不溶性杂质
⑵ 检验HCO3―离子 另取一份滤液,加入NaOH溶液,观察有无沉淀产生
⑶ 同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢
(每空2分,共10分)
16.⑴NaOH溶液和稀硫酸 ⑵在隔绝空气的条件下,蒸发浓缩、冷却结晶 将滤渣F在空气中灼烧 ⑶由滤液A制得氯化铝溶液不合理,所得氯化铝溶液中含有大量NaCl杂质 向滤液A中通入足量的CO2生成Al(OH)3沉淀,过滤,向Al(OH)3沉淀中加入盐酸至沉淀溶解
(每空2分,共10分)
17.⑴CuSO4 ⑵烧杯中有硫酸,黑色固体不溶于硫酸 ⑶①CuS+8HNO3=CuSO4+8NO2↑+4H2O ②所得溶液为蓝色,加BaCl2溶液后有白色沉淀生成 ③将黑色固体在空气中灼烧,比较反应前后固体的质量
(每空2分,共10分)
18.⑴保护臭氧层
⑵①2KHCO3 K2CO3+CO2↑+H2O
K2CO3+CO2↑+H2O
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
⑶Ba(OH)2(或NaOH溶液和BaCl2溶液) 实验时的温度、压强,沉淀的质量
(每空2分,共10分)
19.⑴Na+[ ]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
]2-Na+ ⑵白色物质迅速变为灰绿色,最终变为红褐色
⑶3Fe+4H2O Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe3O4+4H2↑ 在铝热剂上加少量KClO3,插上镁条并将其点燃 ⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
(每空2分,共10分)
20.⑴CH3CHBrCH3 ⑵②④⑤⑦
⑶ +
+ +2H2O
+2H2O
⑷ +2NaOH
+2NaOH +H2O+NaBr
+H2O+NaBr
⑸HOCH2CH2CH2CHO CH3CH(OH)CH2CHO CH3CH2CH(OH)CHO
(CH3)
(第⑸小题4分,其余每空2分,共12分)
21.⑴参加反应的硝酸的物质的量为(13.5mol/L-1mol/L)×0.080 mol/L=1 mol
被还原的硝酸的物质的量即生成气体的物质的量: =0.3 mol
=0.3 mol
则未被还原的硝酸的物质的量为1mol-0.3mol=0.7 mol
即生成物AgNO3、Cu(NO3)2中含NO3-0.7 mol
设合金中银的质量为x,则: ×1+
×1+ ×2=0.7 mol
×2=0.7 mol
解得:x= =0.36(36%)
=0.36(36%)
(4分)
⑵若生成的0.3 mol气体全部是NO2,则应转移电子0.3 mol
若生成的0.3 mol气体全部是NO,则应转移电子0.9 mol
而合金溶于硝酸时转移电子数为: ×1+
×1+ ×2=0.7 mol
×2=0.7 mol
所以生成的气体中既有NO2,又有NO
根据3n(NO)+n(NO2)=0.7 mol n(NO)+n(NO2)=0.3 mol
算出n(NO)=0.2 mol,n(NO2)=0.1 mol
即V(NO)=
(6分)
(1)在烧瓶中加入乙醇、乙酸和浓硫酸外,还应加入___________,目的是___________。
(2)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗中边滴加乙酸边加热蒸馏。这样操作可以提高酯的产率,其原因是:_________________________。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,分离操作步骤流程如下:
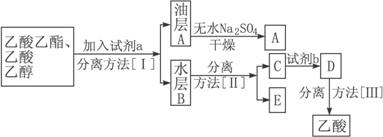
则试剂a是____________________________________,分离方法[Ⅰ]是___________;分离方法[Ⅱ]是____________________________。
试剂b是_________________,分离方法[Ⅲ]是___________________________。
(4)甲、乙两位同学欲将所得的含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来,甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质。丙同学分析了上述实验目标产物后,认为上述实验没有成功。
试回答下列问题:
甲失败的原因是______________________________________________________。
乙失败的原因是______________________________________________________。
查看习题详情和答案>>实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、乙酸和浓硫酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后,换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯的粗产品。请回答下列问题:
(1)在烧瓶中加入乙醇、乙酸和浓硫酸外,还应加入___________,目的是___________。
(2)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗中边滴加乙酸边加热蒸馏。这样操作可以提高酯的产率,其原因是:_________________________。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,分离操作步骤流程如下:
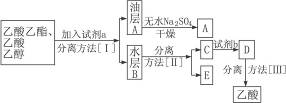
则试剂a是____________________________________,分离方法[Ⅰ]是___________;分离方法[Ⅱ]是____________________________。
试剂b是_________________,分离方法[Ⅲ]是____________________________________。
(4)甲、乙两位同学欲将所得的含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来,甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质。丙同学分析了上述实验目标产物后,认为上述实验没有成功。
试回答下列问题:
甲失败的原因是_________________________________________________________________。
乙失败的原因是_________________________________________________________________。
查看习题详情和答案>>实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)、 配制250mL0.1mol/L的盐酸溶液
| 应称量盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需的其它仪器 |
| | | |
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)、操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为_____________________;
(4)、若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响” )
若没有进行A操作 ;若加蒸馏水时不慎超过了刻度 ;
若定容时俯视刻度线 _______________。
(5)、若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度 ;
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面 。 查看习题详情和答案>>
实验室用NaOH固体配制250 mL 1.25 mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250 mL 1.25 mol/L的NaOH溶液
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
| | | |
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A、用30 mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30 mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为_____________________________;
(5)下列配制的溶液浓度偏低的是 ;
A、称量NaOH时,砝码错放在左盘
B、向容量瓶中转移溶液时(实验步骤②)不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水 查看习题详情和答案>>
实验室用NaOH固体配制250 mL 1.25 mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250 mL 1.25 mol/L的NaOH溶液
|
应称取NaOH的质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它玻璃仪器 |
|
|
|
|
(2)容量瓶上需标有以下五项中的 ;
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A、用30 mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30 mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为_____________________________;
(5)下列配制的溶液浓度偏低的是 ;
A、称量NaOH时,砝码错放在左盘
B、向容量瓶中转移溶液时(实验步骤②)不慎有液滴洒在容量瓶外面
C、加蒸馏水时不慎超过了刻度线
D、定容时俯视刻度线
E、配制前,容量瓶中有少量蒸馏水
查看习题详情和答案>>