2008年11月如皋中学高二年级阶段性考试
化学试题
第Ⅰ卷(选择题 共48分)
可能用到的相对原子质量:H-
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.据报道,最近有两位希腊化学家,把氢气和氮气通入到一加热的电解池中,用多孔钯多晶薄膜催化电解,结果在常压下即获得了氨,且转化率高达75%,远高于通常高温高压催化剂合成氨工艺的转化率(10%~15%)。则下列有关叙述不正确的是
A.在该装置内,氮气在阴极区发生反应
B.使用高效催化剂可以提高合成氨的平衡转化率
C.该过程中有电能转化为化学能
D.合成氨反应是放热的,所以该装置还可以向外界提供能量
2.已知胆矾溶于水时溶液温度降低,室温下将1 mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO4?5H2O(s) = CuSO4(s)+5H2O(l);△H=+Q2 kJ?mol-1则Q1、Q2的关系为
A.Q1<Q2 B.Q1>Q
3.C+CO2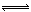 2CO;ΔH1>0,反应速率v1,N2+3H2
2CO;ΔH1>0,反应速率v1,N2+3H2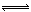 2NH3;ΔH2<0,反应速率v2。如升温,v1和v2的变化是
2NH3;ΔH2<0,反应速率v2。如升温,v1和v2的变化是
A.同时增大 B.同时减少
C.v1增大,v2减少 D.v1减少,v2增大
4.下列事实不能用电化学理论解释的是
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.铝片不用特殊方法保存
D.生铁跟稀硫酸反应比纯铁的反应来得快
5.下列变化不能用勒夏特列原理解释的是
A.红棕色的NO2加压后颜色先变深再变浅
B.KMnO4溶液中加硫酸酸化
C.用Na2CO3溶液处理锅炉水垢,使CaSO4转化为CaCO3
D.热的纯碱溶液去污效果好
6.在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液: Na+、Cl―、SO42―、Fe3+
B.在pH = 1溶液中:NH4+、K+、ClO―、Cl―
C.由水电离的c(H+)=10-12 mol?L―1的溶液:K+、Ba2+、Cl―、Br―
D.有NO3―存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br―
7.BaSO4悬浊液用于肠胃系统放射照片的拍摄。在
A.1.4mg B.2.5mg C.4.1mg D.7.2mg
8.将质量分数为0.052(5.2%)的NaOH溶液
NaOH的质量分数
阳极析出物的质量(克)
阴极析出物的质量(克)
A
0.042(4.2%)
1.2
9.4
B
0.042(4.2%)
9.4
1.2
C
0.062(6.2%)
19
152
D
0.062(6.2%)
152
19
二、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9.下列电离方程式中,书写正确的是
A.NaHCO3在水中的电离:NaHCO3 = Na+ + H+ + CO32―
B.Na2CO3溶于水:CO32-+H2O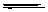 H2CO3+2OH-
H2CO3+2OH-
C.石灰石溶于稀醋酸:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
D.氢氧化镁在饱和氯化氨溶液中溶解:Mg(OH)2 + 2NH4+ = Mg2+ + 2NH3?H2O
10.某新型燃料电池,一极通入空气,另一极通丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该电池说法正确的是
A.在熔融电解质中,O2-由负极移向正极
B.电池总反应是:
C.通入空气的一极是正极,电极反应为:O2+4e- = 2O2-
D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2- = 4CO2+5H2O
11.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+) + c(H+) = c(HRO3-) + c(RO32-) + c(OH-)
C.c(H+) + c(H2RO3) = c(RO32-) + c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
12.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)∶n(硝酸亚汞) = 2∶1,则下列表述正确的是
A.在两个阴极上得到的银和汞的物质的量之比为1∶1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的化学式为HgNO3
D.硝酸亚汞的化学式为Hg2(NO3)2
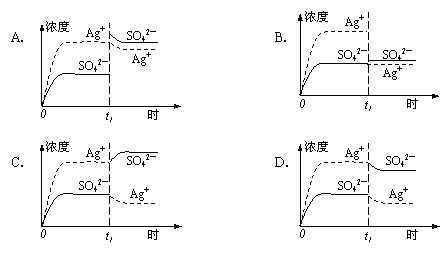
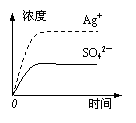 13.已知Ag2SO4的Ksp=2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42―浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034
mol/L)。若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42―浓度随时间变化关系的是
13.已知Ag2SO4的Ksp=2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42―浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034
mol/L)。若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42―浓度随时间变化关系的是

14.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn
+ 2K2FeO4 + 8H2O  3Zn(OH)2 + 2Fe(OH)3
+ 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3
+ 4KOH,下列叙述不正确的是
A.放电时负极反应为:Zn - 2e- + 2OH―= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e- + 5OH― = FeO42―+ 4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的pH下降
第Ⅱ卷(非选择题 共72分)
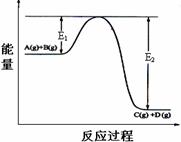 15.反应A(g)+B(g)
15.反应A(g)+B(g)
⑴Q 0(填“>”、“<”或“=”)
⑵该反应平衡常数K的表达式为: ,其他条件不变升高温度K__________(填“增大”“减小”“不变”),原因是_________________________
_____________________________________________
⑶反应体系中加入催化剂,反应速率增大,则E1的变化是:E1_______,ΔH的变化是:ΔH________(填“增大”“减小”“不变”)。
⑷反应在容积可变的密闭容器中进行,将容积缩小到原来一半,c(A)后
16.某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1。
⑴写出邻苯二甲酸氢钾(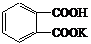 )与NaOH反应的化学方程式:
)与NaOH反应的化学方程式:
。
⑵将用分析天平精确称量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂 (从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是 。
⑶该实验要用到的主要玻璃仪器 (写二种)
⑷该学生进行三次实验,所取固体的质量均相同,填写下表:
实验编号
邻苯二甲酸氢钾的质量(g)
待测NaOH溶液的体积(mL)
1
0.4162
18.25
2
17.04
3
16.96
⑸滴定中误差较大的是第 次实验,造成这种误差的可能原因是(只要写两种):
A.
B.
⑹NaOH溶液的物质的量浓度为 。
17.工业上用MnO2和KOH为原料制取高锰酸钾,主要生产过程分两步进行。第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液进行电解,制取KMnO4。试回答以下问题:
⑴制取K2MnO4的MnO2是这一氧化还原反应的_____________剂(填“氧化”或“还原”),连续搅拌的目的是________________________________。
⑵电解K2MnO4的浓溶液时,两极发生的电极反应式为:
阴极是 ,
阳极是 ,
电解总的反应方程式是 。
18.有原子序数依次增大的4种短周期元素X、Y、Z、W,已知:①X与Z、Y与W分别同主族;②X、Z、W分别与Y都能形成两种常见的化合物;③Y的阴离子与Z的阳离子核外电子排布相同,试根据以上叙述填空:
⑴写出由Y与Z形成的化合物Z2Y2的电子式: ,WY2与X2Y2反应生成粘稠油状液体的化学方程式: 。
⑵用离子方程式表示只含X、Z、W三种元素的化合物的水溶液呈碱性的原因:
。
⑶有两种化合物都只含上述四种元素,它们在水溶液中发生反应生成气体的离子方程式为: 。
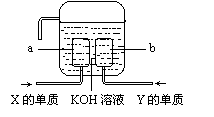 ⑷X、Y两种元素的单质已经被应用于飞船的燃料电池中,如右图所示,两个电极都由多孔性碳构成,通入的两种单质由空隙逸出并在电极表面放电。
⑷X、Y两种元素的单质已经被应用于飞船的燃料电池中,如右图所示,两个电极都由多孔性碳构成,通入的两种单质由空隙逸出并在电极表面放电。
①a是装置的 极。
②b极上的电极反应式是 。
19.铝和氢氧化钾都是重要的工业产品。请回答:
⑴工业冶炼铝的化学方程式是 。
 ⑵铝与氢氧化钾溶液反应的离子方程式是:
⑵铝与氢氧化钾溶液反应的离子方程式是:
。
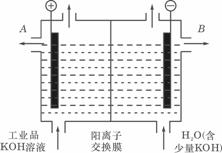
⑶工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是:
。
②通电开始后,阴极附近溶液pH会增大,请简述原因:
③除去杂质后的氢氧化钾溶液从液体出口_______(填写“A”或“B”)导出。
20.某二元酸(化学式用H
H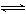 H+
+ A2―
H+
+ A2―
试完成下列问题:
⑴Na
⑵在0.1mol/L的Na
A.c(A2―) + c(HA―) = 0.1mol/L
B.c(OH―) = c(H+) + c(HA―)
C.c(H+) + c(Na+) = c(OH―) + c(HA―) +
D.c(Na+) =
⑶已知0.1mol/L的NaHA溶液的pH = 2,则0.1mol/L的H
量浓度可能 (填“>”、“<”或“=”)0.11mol/L,理由是
。
⑷0.1mol/L的NaHA溶液中各离子浓度由大到小的顺序是:
。
21.酸、碱指示剂本身就是弱酸或弱碱,滴定操作时,酸(碱)首先和被滴定的碱(酸)反应,而后过量酸(碱)和指示剂作用变色,显然指示剂的酸碱性较弱。
沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度比滴定剂和指示剂的生成物的溶解度 (填大、小、相同),否则不能用这种指示剂。
AgCl
AgBr
AgCN
Ag2CrO4
AgSCN
颜色
白
浅黄
白
砖红
白
溶解度mol/L
1.8×10-10
7.1×10-7
1.1×10-8
1.9×10-12
1.0×10-6
⑴若用AgNO3去滴定NaSCN溶液,可选用为滴定的指示剂的物质为
A.NaCl B.BaBr
达到滴定终点时的现象为 。
⑵用AgNO3溶液滴定KCl等含氯离子溶液时常用K2CrO4溶液做指示剂,锥型瓶中现有氯离子浓度约为0.1mol/L KCl溶液18.90mL,向其中加入2滴(共0.1mL)0.2mol/L的Na2CrO4溶液,然后用浓度约为0.1mol/L AgNO3溶液进行滴定。试计算达到终点时溶液中氯离子的最大浓度。
1-8 B A A C B C C D
9-14 D BC C AD B CD
15.(10分)
⑴<(1分)
⑵K =  变小 正反应放热,升高温度,平衡逆向移动,常数减小 (1+1+2分)
变小 正反应放热,升高温度,平衡逆向移动,常数减小 (1+1+2分)
⑶减小 不变 (1+1分)
⑷> 压强增大后,C可能已经液化或者固化 (1+2分)
16.(13分)
⑴略(2分)
⑵酚酞 无色变成浅红色(2分)
⑶碱式滴定管 锥形瓶(2分)
⑸1 滴定管只用水洗,未用NaOH润洗 滴定前滴定管尖嘴处有气泡,滴定后消失 滴定终点判断不准,溶液呈红色(其他合理答案也可以)(1+2 + 2分)
⑹0.1200mol/L (有效数字1分)(2分)
17.(9分)
⑴还原 使与空气充分接触将MnO2充分氧化(1+ 2分)
⑵2H+ + 2e― = H2↑(或2H2O + 2e― = H2↑+ 2OH―) MnO42― ― e― = MnO4―
2K2MnO4
+ 2H2O  2KMnO4 + 2KOH + H2↑(2+2+2分)
2KMnO4 + 2KOH + H2↑(2+2+2分)
18.(10分)
⑴略 H2O2 + SO2 = H2SO4(1+ 2分)
⑵HS―+ H2O H2S
+ OH―(2分)
H2S
+ OH―(2分)
⑶H+ + HSO3― = H2O + SO2↑(2分)
⑷负 O2 + 2H2O + 4e― = 4OH―(1+ 2分)
19.(9分)
⑴2Al2O3 4Al+3O2↑(2分)
4Al+3O2↑(2分)
⑵2Al+2OH―+2H2O=2AlO2-+3H2↑(2分)
⑶①4OH--4e-=2H2O+O2↑(2分)
②H+放电,促进水的电离,OH-浓度增大(2分)
③B(1分)
20.(12分)
⑴碱性 A2―将发生水解 A2―+ H2O  HA― + OH―(1+ 2分)
HA― + OH―(1+ 2分)
⑵ABCD(4分 少1个,扣2分,少2个扣3分,只答对1个或未答0分)
⑶< H
⑷c(Na+)> c(HA―)> c(H+)> c(A2―)> c(OH―) (2分)
21.(9分)
小(2分)
⑴D 混合物中有砖红色沉淀生成(1+ 2分)
⑵由AgCl、Ag2CrO4的溶度积常数计算可知道,AgCl溶解度更小,加硝酸银
所以当Cl―全部被消耗时,混合体系的总体积约为40mL,此时
c(CrO42―) =  =5.26×10―4 mol/L
=5.26×10―4 mol/L
c(Ag+) =  =6×10―5 mol/L(AgNO3过量很少即可)
=6×10―5 mol/L(AgNO3过量很少即可)
c(Cl―) =  = 3×10―6 mol/L
< 1×10―5 mol/L(Cl―沉淀完全)(4分)
= 3×10―6 mol/L
< 1×10―5 mol/L(Cl―沉淀完全)(4分)