网址:http://m.1010jiajiao.com/timu_id_186558[举报]
1-8 B A A C B C C D
9-14 D BC C AD B CD
15.(10分)
⑴<(1分)
⑵K =  变小 正反应放热,升高温度,平衡逆向移动,常数减小 (1+1+2分)
变小 正反应放热,升高温度,平衡逆向移动,常数减小 (1+1+2分)
⑶减小 不变 (1+1分)
⑷> 压强增大后,C可能已经液化或者固化 (1+2分)
16.(13分)
⑴略(2分)
⑵酚酞 无色变成浅红色(2分)
⑶碱式滴定管 锥形瓶(2分)
⑸1 滴定管只用水洗,未用NaOH润洗 滴定前滴定管尖嘴处有气泡,滴定后消失 滴定终点判断不准,溶液呈红色(其他合理答案也可以)(1+2 + 2分)
⑹0.1200mol/L (有效数字1分)(2分)
17.(9分)
⑴还原 使与空气充分接触将MnO2充分氧化(1+ 2分)
⑵2H+ + 2e― = H2↑(或2H2O + 2e― = H2↑+ 2OH―) MnO42― ― e― = MnO4―
2K2MnO4
+ 2H2O  2KMnO4 + 2KOH + H2↑(2+2+2分)
2KMnO4 + 2KOH + H2↑(2+2+2分)
18.(10分)
⑴略 H2O2 + SO2 = H2SO4(1+ 2分)
⑵HS―+ H2O H2S
+ OH―(2分)
H2S
+ OH―(2分)
⑶H+ + HSO3― = H2O + SO2↑(2分)
⑷负 O2 + 2H2O + 4e― = 4OH―(1+ 2分)
19.(9分)
⑴2Al2O3 4Al+3O2↑(2分)
4Al+3O2↑(2分)
⑵2Al+2OH―+2H2O=2AlO2-+3H2↑(2分)
⑶①4OH--4e-=2H2O+O2↑(2分)
②H+放电,促进水的电离,OH-浓度增大(2分)
③B(1分)
20.(12分)
⑴碱性 A2―将发生水解 A2―+ H2O  HA― + OH―(1+ 2分)
HA― + OH―(1+ 2分)
⑵ABCD(4分 少1个,扣2分,少2个扣3分,只答对1个或未答0分)
⑶< H
⑷c(Na+)> c(HA―)> c(H+)> c(A2―)> c(OH―) (2分)
21.(9分)
小(2分)
⑴D 混合物中有砖红色沉淀生成(1+ 2分)
⑵由AgCl、Ag2CrO4的溶度积常数计算可知道,AgCl溶解度更小,加硝酸银
所以当Cl―全部被消耗时,混合体系的总体积约为40mL,此时
c(CrO42―) =  =5.26×10―4 mol/L
=5.26×10―4 mol/L
c(Ag+) =  =6×10―5 mol/L(AgNO3过量很少即可)
=6×10―5 mol/L(AgNO3过量很少即可)
c(Cl―) =  = 3×10―6 mol/L
< 1×10―5 mol/L(Cl―沉淀完全)(4分)
= 3×10―6 mol/L
< 1×10―5 mol/L(Cl―沉淀完全)(4分)
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
- 3 |
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH
(3)查阅资料发现NaHCO3的分解温度为150℃,丙断言
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| PH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)只要在加热煮沸的溶液中加入足量的试剂X,如果产生白色沉淀,则
A.氢氧化钡溶液 B.氯化钡溶液 C.氢氧化钠溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的PH等于8.3,则
(3)查阅资料发现,NaHCO3的分解温度为150℃,丙断言
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
丙同学认为甲、乙的判断都不充分.丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则
(2)将加热后的溶液冷却到10℃,若溶液的pH
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH-浓度分别为amol/L和bmol/L,则a与b的关系:
| 温度(℃) | 10 | 20 | 30 | 40 | 70 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH
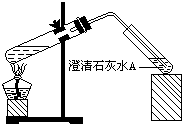
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明
(5)将一定体积0.1mol/L的NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为10.4;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为9.5.据此资料可以判断