上海市控江中学高二化学第一学期期中考试卷(2008.11)
姓名 班级 学号 得分
相对原子质量:H―1 O―16 Fe―56
一、选择题(每小题只有一个选项符合题意,共50分)
1.人体内含量最高的金属离子是
A. Mg2+ B.Ca2+ C.Na+ D.Fe2+
2.进行中和滴定时,事先不应该用所盛溶液润洗的仪器是
A. 酸式滴定管 B. 碱式滴定管 C. 锥形瓶 D. 量筒
3.下列物质中,导电性能最差的是
A. 熔融氢氧化钠 B. 石墨棒 C. 盐酸溶液 D. 固态氯化钾
4. 下列溶液PH小于7的是
A. 溴化钾 B. 硫酸铜 C. 硫化钠 D.硝酸钡
5.下列性质中,不属于金属共同性质的是
A.导电、导热性 B.金属光泽 C.熔点较高 D.延展性
6.下列污水处理方法只涉及物理变化的是
A.过滤法 B.氧化还原法
C.中和法 D.化学沉淀法
7.金属的冶炼有三种方法,那么冶炼银、铁、铝分别应采用
A.热分解法、热还原法、电解法 B.热还原法、热分解法、电解法
C.电解法、热还原法、热分解法 D.电解法、热分解法、热还原法
8.用食用白醋(醋酸浓度约1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
A.白醋中滴入石蕊试液呈红色 B.加热白醋有刺激性气味产生
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示白醋的pH为2.3
9.下列电离方程式中,错误的是
A.H2CO3  H++HCO3- HCO3-
H++HCO3- HCO3-  H++CO32-
H++CO32-
B.NaHSO4→Na++ H++SO42-
C.NaHS→Na++H++S2-
D.CH3COOH  H+ + CH3COO?
H+ + CH3COO?
10. 在稀硫酸中插入一块铁片,再加入下列物质,可使铁片迅速发生腐蚀的是
A.稀盐酸 B.氢氧化钠固体 C.硫酸铜晶体 D.氯化钾晶体
11.有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处。把滴定管中的溶液全部流下排出,承接在量筒中,量筒内溶液的体积
A.大于40.00mL B. 为40.00mL C.小于40.00mL D.为10.00mL
12.下列过程或现象与盐类水解无关的是
A. 纯碱溶液去油污 B. 铁在潮湿的环境下生锈
C. 加热氯化铁溶液颜色变深 D. 明矾净水原理
13.下列说法正确的是
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是纯金属单质
C. 炼铁是铁矿石的氧化过程
D.镁合金的硬度和强度均高于纯镁
14.
A.前者大 B.后者大 C.相等 D.无法判断
15. 钢铁发生吸氧腐蚀时,正极上发生的反应为
A.2Fe-4e →2Fe2+ B.2Fe2++4e →2Fe
C.2H2O+O2+4e →4OH- D.Fe3++e →Fe2+
16.
A. 大于7 B. 小于
17. pH=3的盐酸和pH=3的醋酸溶液,由水电离产生的c(H+)
A. 前者大于后者 B. 前者小于后者 C. 前者等于后者 D. 不能确定
18.离子检验的常用方法有三种:
检验方法
沉淀法
显色法
气体法
含义
反应中有沉淀产生或溶解
反应中有颜色变化
反应中有气体产生
下列离子检验的方法不合理的是
A. NH4+-气体法 B. I--沉淀法 C. Fe3+-显色法 D. Ca2+-气体法
19.下列实验可行的是
A.用澄清石灰水检验CO中含有的CO2
B.用BaCl2除去NaOH溶液中混有的少量Na2SO4
C.用KSCN溶液检验溶液中含有的Fe2+
D.用溶解、过滤的方法分离CaCl2和NaCl固体混合物
20. 下列离子方程式书写正确的是
A.氯化铁溶液和氨水反应:Fe3+ + 3OH? ® Fe(OH)3↓
B.向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+→CO2↑+H2O
 C.用碳棒作电极电解氯化铜溶液:2Cl― + Cu2+ ® Cu + Cl2
C.用碳棒作电极电解氯化铜溶液:2Cl― + Cu2+ ® Cu + Cl2
D.碳酸钠溶液水解:CO32? + H2O H2CO3 + 2OH?
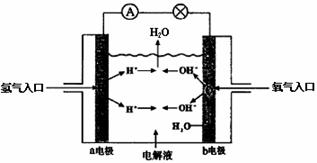
21. 下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A. a电极是负极
B. b电极的电极反应为:4OH--4e →2H2O+O2
C. 氢氧燃料电池是一种具有应用前景的绿色电源
D. 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
22.判断下列有关化学基本概念的依据正确的是
A. 氧化还原反应:元素化合价是否变化 B. 共价化合物:是否含有共价键
C. 强弱电解质:溶液的导电能力大小 D. 金属晶体:熔融晶体是否能够导电
23. 在下列透明溶液中,因氧化还原反应而不能大量共存的离子组是
A.Na+、K+、H+、S2? B.Cl―、Al3+ 、OH? 、Na+
C.Na+、CH3COO―、H+ 、K+ D.K+、I―、Na+、Fe3+
24.用标准NaOH溶液滴定未知浓度的盐酸溶液,以测定盐酸的浓度,下列操作使测定结果偏高的是
A.未知浓度盐酸用滴定管量取,该滴定管用蒸馏水洗涤后未用待测液润洗
B.装待测液的锥形瓶,洗涤后未干就盛入待测液
C.滴定开始时,用仰视法观察碱式滴定管刻度,其余操作正确
D.滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液
25.Fe3O4与HNO3反应生成Fe(NO3)3、NO、H2O若溶解1mol Fe3O4,则被还原的硝酸是
A.1/2mol B. 1/3mol C. 3mol D. 9mol
二、填空题(共25分)
26.有一学生用实验测某溶液的PH值。实验时,他先用蒸馏水润湿PH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作方法 (填“正确”或“不正确”)理由是 。
(2) 检测纯碱溶液呈 性,可用它来清洗油污,其原因是_____________________(请用离子方程式表示)
27.用化学方法除去下列各物质中混有的少量杂质(括号内为杂质),写出有关的离子方程式:
杂质 所加试剂 离子方程式
(1) FeCl2(FeCl3): 、
(2) FeCl3(FeCl2): 、
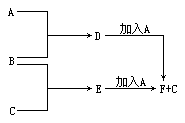 28. A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如右图:
28. A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如右图:
填写下列空白:物质(写化学式)A是______ B是______
C是______D 是 E 是 F是
29.判断存放的FeCl2溶液是否变质。从现象观察看 ;鉴定的方法为加入 试剂,若溶液出现 ;则证明有 存在,鉴定反应的离子方程式 。
三、实验题(共12分)
30.在实验室里制取少量FeCl3,可按照一定顺序连接下图中所列装置,所通过的气体过量且反应充分。试回答以下问题:
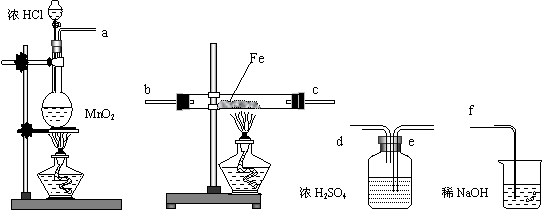
A B C D
(1)实验时,各装置接口的连接顺序为 (用a、b、c、d等字母表示);
(2)C装置的作用是 ;
(3)D装置的作用是 ;
(4)检验B装置中反应后铁是否有剩余的方法是: ;
(5)用此方法可制得无水氯化铁。你认为能否改用Fe和盐酸反应,再通入过量氯气、蒸干溶液的方法来制取无水氯化铁, (答:是或否);说明理由: 。
四、计算题(31题7分,32题6分,共13分)
31. 如果酸碱滴定的实验数据如下表所示,试通过计算确定NaOH溶液的物质的量浓度。
实验编号
盐酸的浓度mol/L
盐酸的体积/mL
待测NaOH溶液的体积/mL
1
0.1154
26.72
25.00
2
0.1154
26.70
25.00
32.
(1)铁粉与稀硝酸反应后得所Fe3+的物质的量。
(2)铁粉与稀硝酸反应后所得Fe2+的物质的量。
(3)原稀硝酸的物质的量浓度。
控江中学高二化学第一学期期中考试答题纸
姓名 班级 学号 得分
相对原子质量:H―1 O―16 Fe―56
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
二、填空题(共25分)
26.(1) 。
(2) 性, _________________ ______ _ ___(离子方程式表示)
27. 所加试剂 离子方程式
(1) 、
(2) 、
28.(写化学式)A___ ___B ___ ___C ___ ___D E F
29. ; ;
。
三、实验题(共12分)
30.(1) (用a、b、c、d等字母表示)
(2) ;
(3) ;
(4) ;
(5) ;
四、计算题(31题7分,32题6分,共13分)
31.
32.
相对原子质量:H―1 O―16 Fe―56
一、选择题(只有一个选项符合题意,每小题2分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
B
C
D
B
C
A
A
D
C
C
A
B
D
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
B
C
C
C
D
A
C
B
A
D
D
B
二、填空题(共25分)
26. 不正确 ,将溶液稀释了,测定不准确
_碱__ 、 CO32?+ H2O →_HCO3- + OH? ____
27. 所加试剂 离子方程式
(3) Fe 、 2Fe3+ + Fe → 3Fe2+
(4) Cl2 、 2Fe2+ + Cl2 → 2Fe3+ + 2Cl?
28.(写化学式)A_ Fe _B __Cl2 __C H2 ___D FeCl3 E HCl F FeCl2
29. 溶液呈黄色 ; KSCN 红色 ; Fe3+
Fe3+ + 3SCN- → Fe(SCN)3 。
三、实验题(共12分)
30.(1) a e d b c f
(2) 干燥氯气 ;(3) 吸收尾气氯气 ;
(4) 用磁铁吸引产物,若被磁铁吸引,则含有铁 ;
(5) 否 ; 由于FeCl3 水解,加热蒸干该溶液只能得到Fe(OH)3
四、计算题(31题7分,32题6分,共13分)
31. 0.1233mol/L 32. (1) 0.01mol (2) 0.03mol (3) 2.4mol/L