网址:http://m.1010jiajiao.com/timu_id_185390[举报]
相对原子质量:H―1 O―16 Fe―56
一、选择题(只有一个选项符合题意,每小题2分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
B
C
D
B
C
A
A
D
C
C
A
B
D
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
B
C
C
C
D
A
C
B
A
D
D
B
二、填空题(共25分)
26. 不正确 ,将溶液稀释了,测定不准确
_碱__ 、 CO32?+ H2O →_HCO3- + OH? ____
27. 所加试剂 离子方程式
(3) Fe 、 2Fe3+ + Fe → 3Fe2+
(4) Cl2 、 2Fe2+ + Cl2 → 2Fe3+ + 2Cl?
28.(写化学式)A_ Fe _B __Cl2 __C H2 ___D FeCl3 E HCl F FeCl2
29. 溶液呈黄色 ; KSCN 红色 ; Fe3+
Fe3+ + 3SCN- → Fe(SCN)3 。
三、实验题(共12分)
30.(1) a e d b c f
(2) 干燥氯气 ;(3) 吸收尾气氯气 ;
(4) 用磁铁吸引产物,若被磁铁吸引,则含有铁 ;
(5) 否 ; 由于FeCl3 水解,加热蒸干该溶液只能得到Fe(OH)3
四、计算题(31题7分,32题6分,共13分)
31. 0.1233mol/L 32. (1) 0.01mol (2) 0.03mol (3) 2.4mol/L
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
| ||
| ||
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
(5)已知:2CD2(g)
 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.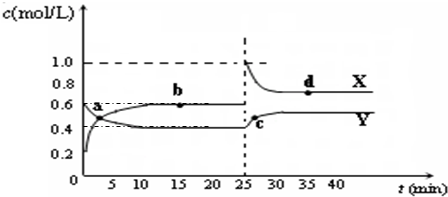
①a、b、c、d四个点中,化学反应处于平衡状态的是
②25min时,增加了
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
请回答下列问题:
(1)B与甲反应的化学方程式是
| ||
| ||
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
(4)写出A与水蒸气反应生成C和甲的化学方程式
| ||
| ||
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是
| n |
| 33.6 |
| n |
| 33.6 |
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为
| m |
| 11.2 |
| m |
| 11.2 |
| m-n |
| 22.4 |
| m-n |
| 22.4 |
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为
(18分)A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的单质是自然界最轻的气体,E单质须保存在煤油中。A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)N的电子式为 ;M分子中含有 (填“极性”或“非极性”)键
(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式
反应后水溶液显 (填“酸”“碱”或“中”)性,原因是 (用离子方程式表示)
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质。则其负极反应为 ;一段时间后,溶液pH (填“增大”“减小”或“不变”)。
![]() (5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是 (选填序号字母)。
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质
查看习题详情和答案>>
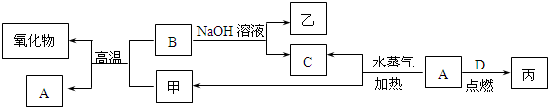
(15分)A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,其中D为黄绿色。甲、乙、丙为常见的化合物。它们之间的转化关系如下图所示:
回答下列问题:
(1)化合物乙的名称__________。
(2)B与甲反应的化学方程式是____________________。
(3)由丙的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是__________;若要提纯该胶体,采用的操作方法叫_____。如果用该胶体做电泳实验,___极附近颜色加深。
(4)将A、B两种金属按一定的质量比组成混合物。
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为nL,混合物中B的物质的量为_____mol(用含字母的代数式表示)。
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积的标准状况下为mL,该反应中转移电子的物质的量为_____mol,原混合物中A的质量为__________g(用含字母的代数式表示)。
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌后,过滤,沉淀经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中B的质量分数为_____。
(18分)A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的单质是自然界最轻的气体,E单质须保存在煤油中。A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)N的电子式为 ;M分子中含有 (填“极性”或“非极性”)键
(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式
反应后水溶液显 (填“酸”“碱”或“中”)性,原因是 (用离子方程式表示)
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质。则其负极反应为 ;一段时间后,溶液pH (填“增大”“减小”或“不变”)。 (5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是 (选填序号字母)。
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质